01.12.2020

Несмотря на все сложности и проблемы, которые принес нам 2020 год, он запомнится нам и появлением новых исследований, способных изменить существующую практику лечения онкологических больных. В немалой степени это касается лучевой терапии. В первой половине года мы познакомились с результатами трех крупных проспективных рандомизированных исследований, продемонстрировавших адекватность и даже преимущества коротких гипофракционированных режимов облучения при раке молочной железы (FAST-Forward и FAST [1,2]) и прямой кишки (RAPIDO [3]), – эти результаты приобретают особое значение в условиях пандемии COVID-19. Конгресс ESMO представил долгожданное исследование Lung ART [4], поставившее под сомнение необходимость адъювантной лучевой терапии при НМРЛ N2, а также CheckMate 577, подтвердившее явные преимущества применения ниволумаба в адъювантном режиме у больных раком пищевода после тримодального лечения [5] (rosoncoweb.ru/news/oncology/2020/09/25/). Приближаясь к финалу 2020 года, обратим внимание еще на две публикации, способные изменить существующую практику.
Для опухолей, которые могут быть радикально пролечены консервативным путем – т.е. с применением лучевой терапии и системного лечения – принципиально важна последовательность использования этих методов. Наиболее частая практика ведения больных раком предстательной железы подразумевала начало лечения с гормонотерапии (АДТ – андроген-депривационной терапии) в течение нескольких месяцев с последующим подключением радикальной лучевой терапии. На конгрессе ASTRO 2020 профессор Daniel Spratt (один из лекторов совместной ASTRO-RUSSCO сессии XXIV Российского онкологического конгресса) представил результаты совокупного анализа 2 рандомизированных исследований III фазы, основной целью которого стало определение оптимального соотношения АДТ и лучевой терапии [6]. Индивидуальные данные 1065 пациентов были получены из исследований Malone et al. 2019 года [7] и RTOG 9413 [8], в которых неоадъювантная АДТ с последующей ЛТ сравнивалась с немедленной ЛТ и АДТ в адъюванте. Лучевая терапия проводилась только на простату. За солидный период наблюдения (медиана составила 14,9 лет) раннее начало лучевой терапии с адъювантной АДТ продемонстрировало преимущества по многим показателям: частоте биохимических рецидивов за 15 лет (33% против 43%; HR 1,37; 95% CI 1,12-1,68; p=0,002), отдаленному метастазированию за 15 лет (12% против 18%; HR 1,40; 95% CI 1,00-1,95; p=0,04) и выживаемости без прогрессирования (36% против 29%; HR 1,25; 95% CI 1,07-1,47; p=0,01). При опухолях высокого риска адъювантная АДТ позволила достоверно снизить раково-специфичную смертность, при этом явных различий в частоте и выраженности осложнений не было.
Подобный совокупный анализ продемонстрировал, что последовательность гормонотерапии и облучения влияет на отдаленные результаты лечения неметастатического рака предстательной железы, и еще раз показал, что ранее начало лучевой терапии имеет огромное значение в лечении тех опухолей, где она традиционно применяется с радикальной целью.
Другое крупное исследование заставляет задуматься об обратном.
В план лечения больных раком эндометрия ≥II стадии традиционно включалась лучевая терапия, поскольку частота локорегиональных рецидивов при РЭ высокого риска после только адъювантной химиотерапии достигает 20% и даже более. Однако исследований, которые напрямую сравнили бы результаты адъювантной химио- и химиолучевой терапии при III-IV стадии, явно недоставало.
В проспективное рандомизированное исследование 3 фазы от американских авторов, результаты которого были опубликованы недавно в New England Journal of Medicine [9], было набрано 816 больных раком эндометрия (подавляющее большинство в IIIА-С2 стадии), их которых 707 были распределены в 2 группы: адъювантной ХТ (карбоплатин/паклитаксел 6 курсов каждые 3 недели) и адъювантного химиолучевого лечения (цисплатин 50 мг/м2 1 раз в 4 недели на фоне облучения в дозе 45 Гр ± брахитерапия, затем карбоплатин/паклитаксел 4 курса). В первую очередь авторы хотели выяснить, увеличивает ли адъювантное химиолучевое лечение безрецидивную выживаемость, а также способствует ли улучшению показателей общей выживаемости. Средний период наблюдения составил 47 месяцев. Как и ожидалось, ХЛТ оказалась достоверно более токсичной в плане развития осложнений со стороны ЖКТ и мочеполовой системы (90% против 79% и 33% против 11% соответственно, p<0,001), что отразилось на более низком качестве жизни (по данным опросников). Но в отношении основной цели исследования – безрецидивной выживаемости – эта токсичность оказалась неоправданной: 5-летняя БРВ составила 59% в группе ХЛТ и 58% в группе ХТ (рис.1).
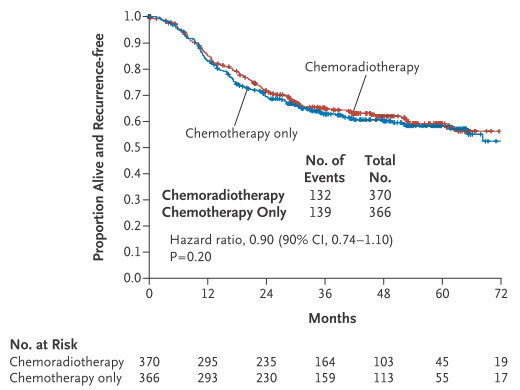
Рисунок 1. Безрецидивная выживаемость после адъювантной ХТ или ХЛТ.
Адъювантная ХЛТ способствовала снижению риска локорегиональных рецидивов (2% против 7%), а также рецидивов в парааортальных лимфоузлах (11% против 20%), но частота отдаленных метастазов, от которых погибает большинство пациенток с местнораспространенным раком эндометрия, в этой группе была достоверно выше (27% против 21%). Очевидно, отсрочивание более чем на месяц начала адекватной адъювантной химиотерапии, происходящее по причине проведения локальной терапии, критически негативно сказывается на отдаленных результатах. Более того, после завершения ХЛТ лишь 75% женщин смогли закончить последующую ХТ в полном объеме. Авторы предполагают, что если проведение локального адъювантного лечения действительно необходимо по мнению мультидисциплинарного консилиума, то делать это нужно уже по завершении ХТ. Вариант популярного (в том числе и в России) «сэндвич-курса», когда адъювантная ХТ прерывалась для проведения облучения и продолжалась после его завершения, был предложен лишь на основании небольших ретроспективных работ и должен быть исследован более основательно.
Представленные новые данные этих двух исследований действительно должны заставить нас задуматься, сравнить и оценить свои подходы к лечению пациентов с этими столь распространенными злокачественными опухолями.
Источники: