06.12.2023
Лекарственная терапия мелкоклеточного рака легкого (МРЛ) позволяет увеличить медиану общей выживаемости, контролировать симптомы болезни и сохранить качество жизни пациента, однако опции лечения ограничены. Разработка новых опций терапии является актуальной задачей.
Тарлатамаб (AMG 757) – биспецифическое антитело, связывающее между собой дельта-подобный лиганд 3 (DLL3), экспрессирующийся на клетках МРЛ, и рецептор CD3, представленный на T-лимфоцитах. Взаимодействие опухолевых клеток с Т-лимфоцитами приводит к активации T-клеточного иммунного ответа (рис.1).
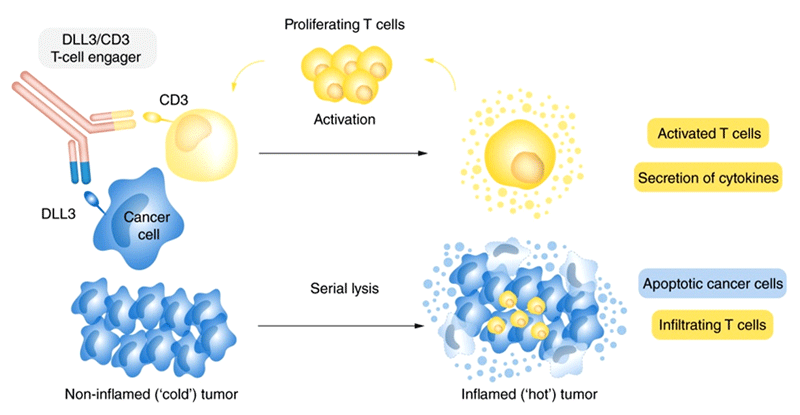
Рисунок 1. Механизм действия тарлатамаба.
DLL3 является мембранным белком, взаимодействие DLL3 с рецептором Notch1 приводит к деградации рецептора и ингибированию сигнального пути Notch.
В исследовании 2 фазы DeLLphi-301 изучалась эффективность тарлатамаба в поздних линиях лечения МРЛ. Исследование обладало сложным трехэтапным дизайном, задачей которого был подбор оптимальной дозы тарлатамаба. Дизайн исследования представлен на рисунке 2.
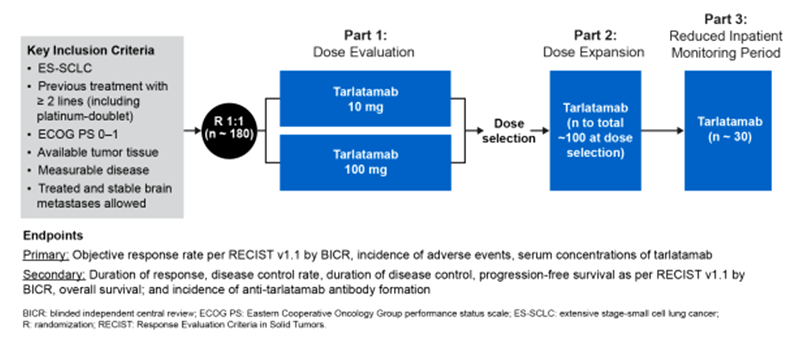
Рисунок 2. Дизайн исследования DeLLphi-301.
Уровень экспрессии DLL3 оценивался ретроспективно методом ИГХ с использованием антитела SP347.
Первичной конечной точкой была частота достижения объективного ответа (ОО), вторичными – длительность достигнутого ОО, контроль роста опухоли (КРО), длительность КРО, медианы выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) и токсичность терапии.
С декабря 2021 г. по май 2023 г. в исследование включено 222 пациента, в 1 часть – 176 больных, которых рандомизировали в две лечебные группы (1:1):
После проведения промежуточного анализа (оценка токсичности и эффективности) была выбрана доза в 10 мг. На всех трех этапах исследования пациенты получали тарлатамаб в дозе 1 мг в 1-й день 1-го цикла, далее – целевую дозу 10 мг или 100 мг в 8-й и 15-й день 1-го цикла и далее каждые 2 недели.
Во вторую и третью части работы было включено еще 12 и 34 больных соответственно.
Большинство пациентов в исследовании были ранее курившими мужчинами без метастазов в головном мозге, с ECOG статусом 1, ранее получавшие анти-PD-L1 или PD-1 терапию и с 2 и более линиями лечения в анамнезе.
В анализ эффективности включены результаты терапии 176 больных. Медиана времени наблюдения составила 10,6 мес. в группе с дозовым режимом 10 мг и 10,3 мес. в группе с дозовым режимом 100 мг.
Объективный ответ достигнут у 40% пациентов в группе, принимавшей тарлатамаб в дозе 10 мг, и у 32% в группе 100 мг. Подробно результаты терапии представлены в таблице.
| Тарлатамаб 10 мг (n=100) |
Тарлатамаб 100 мг (n=88) |
|
|---|---|---|
| Эффект терапии | ||
| Объективный ответ | 40 (40%) | 28 (32%) |
| Стабилизация терапии | 30 (30%) | 27 (31%) |
| Прогрессирование | 20 (20%) | 13 (15%) |
| Эффект не оценен | 10 (10%) | 20 (23%) |
| Длительность объективного ответа | ||
| ≥3 мес. | 88% | 89% |
| ≥6 мес. | 58% | 61% |
| ≥9 мес. | 25% | 36% |
| Медиана длительности КРО, мес. | 6,9 (5,4-9,7) | 6,7 (4,2-НД) |
| Медина ВБП, мес. | 4,9 | 3,9 |
Медиана ВБП в группе с тарлатамабом в 10 мг составила 4,9 мес. и 3,9 мес. в когорте 100 мг, при 6-месячной ВБП в 40% и 34% и 9-месячной ВБП в 28% и 27% в группах соответственно.
Представлены образцы опухолевой ткани 157 пациентов (84%), из них 83 пациента (83%) в группе 10 мг и 74 пациента (84%) в группе 100 мг, в 151 (96%) случае подтвержден положительный статус DLL3. Частота регистрации ОО не зависела от статуса DLL3.
Нежелательные явления 3 степени и выше зарегистрированы у 58% больных в группе 10 мг и у 64% в группе 100 мг и были преимущественно представлены синдром выброса цитокинов (3% и 6%), нейротоксичностью (0% и 5%) и нейтропенией (6% и 10%).
Источники: