Новости онкологии
13.07.2022
Новости ASCO 2022. Рак пищевода и желудка
Трякин Алексей Александрович
Заместитель директора по научной работе НИИ клинической онкологии им. акад. РАН и РАМН Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, заведующий отделением противоопухолевой лекарственной терапии №2, национальный представитель России в ESMO, член правления RUSSCO, доктор медицинских наук, Москва
Конгресс ASCO в этом году оказался не особо богатым на интересные исследования по раку пищевода и желудка, явно отдав предпочтение колоректальному раку. Тем не менее, несколько из опубликованных работ интересны для обсуждения.
Рак пищевода
Самостоятельная химиолучевая терапия (ХЛТ) занимает значимое место в лечении локализованного рака пищевода. В качестве компаньона ЛТ обычно выступают комбинации цисплатина с фторурацилом и паклитаксел + карбоплатин. В исследовании III фазы из Китая 201 пациент с плоскоклеточным раком получил ХЛТ с комбинацией паклитаксел + цисплатин ± нимотузумаб [1]. Нимотузумаб – моноклональное антитело, блокирующее EGFR1. В отличие от цетуксимаба и панитумумаба, оно характеризуется меньшей аффинностью к рецепторам, что приводит к значительно меньшей дерматологической токсичности. На ASCO 2022 были сообщены промежуточные результаты по частоте объективного ответа. Применение моноклонального антитела позволило существенно увеличить частоту полных клинических ответов с 12,2% до 32,5%. Ранее предпринимались попытки добавления цетуксимаба к самостоятельной ХЛТ, приведшие лишь к ухудшению общей выживаемости (ОВ) за счет, по-видимому, большей токсичности режима [2]. В исследовании с нимотузумабом последний не ухудшил переносимость ХЛТ, что, возможно, и определило улучшение непосредственных результатов. Данные по ОВ ожидаются.
Основой лечения метастатического плоскоклеточного рака пищевода долгие годы являются дуплеты на основе цисплатина с фторпиридинами или с таксанами. При этом реальная польза этой ХТ, а также возможность ее деэскалации (например, у ослабленных пациентов) оставались неизвестными. Ученые из Индии провели исследование III фазы, в котором больные плоскоклеточным раком сравнили еженедельный паклитаксел с поддерживающей терапией (best supportive care). ХТ позволила значимо увеличить продолжительность жизни с 4,2 до 8,6 мес. (HR 0,52; 95% CI 0,40-0,66) [3]. Стоит только предполагать, что добавление к паклитакселу цисплатина привело бы к еще большему выигрышу в ОВ.
Рак желудка
Периоперационная ХТ режимом FLOT стала стандартом терапии локализованного рака желудка на основании единственного, хотя и хорошо спланированного исследования. В то же время в странах Азии для адъювантной или периоперационной терапии активно применяются комбинации SOX (S1 + оксалиплатин) или DOS (доцетаксел, оксалиплатин, S1). В рандомизированном исследовании II фазы MATCH (Китай) пациенты получали по 4 курса периоперационной ХТ этими режимами. Режим с доцетакселом достоверно улучшил 3-летние ВБП с 35% до 52% и ОВ с 49,2% до 57,5%, вновь подтвердив свое значение в лечении резектабельного рака желудка [4].
Можем ли мы улучшить эффективность FLOT за счет добавления к нему таргетных препаратов? Обновленные результаты рандомизированного исследования RAMSES (FLOT ± рамуцирумаб) вновь не смогли показать преимущества экспериментального режима, за исключением большей частоты R0-резекций [5]. В небольшом исследовании PETRARCA (FLOT ± пертузумаб/трастузумаб) удалось значимо улучшить частоту pCR при тенденции к пролонгации ВБП и ОВ ценой существенного роста токсичности (по моему мнению, пертузумаб в этом исследовании был лишним) [6]. Однако малое число больных не смогло дать четкие рекомендации о необходимости интеграции анти-HER2 терапии в периоперационную терапию. Перспективной опцией выглядит попытка применения химиоиммунотерапии. В рандомизированном исследовании II фазы DANTE 295 пациентов получали терапию FLOT ± атезолизумаб [7]. Лишь 8% больных имели MSI-high и 29% – PD-L1 CPS ≥5. Пока доступны результаты только по частоте патоморфологических регрессий. У пациентов с MSI-high частота pCR улучшилась с 27% до 50%, а в группе c CPS ≥10 – c 14% до 38%. Высокая эффективность иммунотерапии у пациентов с MSI-high раком желудка в контексте предоперационной терапии была недавно продемонстрирована в метаанализе исследований II фаз: частота pCR в этой группе составила 39% [8]. Все это, на мой взгляд, говорит о возможности интеграции иммунотерапии в режимы периоперационной терапии уже сегодня.
Исследование CheckMate 649 установило новый стандарт первой линии терапии метастатического рака желудка с экспрессией PD-L1 CPS ≥5 – комбинацию FOLFOX/XELOX с ниволумабом. В самом исследовании 60% больных имели столь высокую экспрессию, что позволяло врачам надеяться на столь широкое внедрение нового подхода, а организаторам здравоохранения с печалью думать, где изыскать на нее столько средств. Неожиданной преградой к внедрению данного подхода в России является отсутствие у нас регистрации антитела 28-8, что ставит вопрос о легитимности использования по этому показанию других антител. На ASCO 2022 было представлено исследование из Сингапура, где сравнили конкордантность разных антител – Dako 28-8, Dako 22C3, Ventana SP-142 [9]. Оказалось, что применение двух последних занижает частоту экспрессии CPS ≥5 вдвое (рис.1). Основываясь на результатах данного исследования, можно пока лишь констатировать, что в отсутствие клона 28-8 пациентов кандидатов для химиоиммунотерапии мы будем встречать значительно реже, чем в пределах ранее предполагаемых 60%.
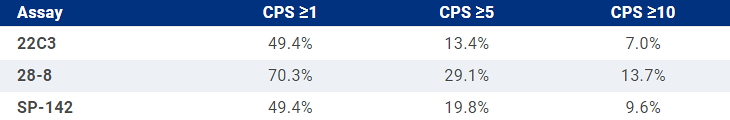
Рисунок 1. Частота экспрессии PD-L1 при раке желудка с использованием различных антител.
Можно ли улучшить эффективность химиоиммунотерапии за счет комбинации ХТ + анти-PD1 + анти-CTLA4 антитела? К сожалению, нет. В двух небольших рандомизированных исследованиях комбинации FOLFOX + ниволумаб + ипилимумаб (I линия) и FOLFIRI + дурвалумаб + тремелимумаб (II линия) не смогли показать большую эффективность по сравнению с режимами без анти-CTLA4 антител [10,11].
Источники:
- Thomas Crosby, Christopher N Hurt, Stephen Falk, et al. Chemoradiotherapy with or without cetuximab in patients with oesophageal cancer (SCOPE1): a multicentre, phase 2/3 randomised trial. Lancet Oncol. 2013 Jun; 14(7): 627-37.
- Xue Meng, Anping Zheng, Jun Wang, et al. Nimotuzumab plus concurrent CRT versus CRT in unresectable locally advanced esophageal squamous cell carcinoma (ESCC): Interim analysis from a prospective, randomized-controlled, double-blinded, multicenter, and phase III clinical trial (NXCEL1311 Study). J Clin Oncol. 2022; 40 (suppl 16; abstr. 4016).
- Vanita Noronha, Vijay Maruti Patil, Nandini Sharrel Menon, et al. Phase III randomized controlled trial comparing chemotherapy to best supportive care in advanced esophageal and gastroesophageal junction cancer. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4065).
- Ryan Yong Kiat Tay, Joe Poh Sheng Yeong, Jeffrey Lum, et al. Choice of PD-L1 immunohistochemistry assay influences clinical eligibility for gastric cancer immunotherapy. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4026).
- Sylvie Lorenzen, Peter C. Thuss-Patience, Jorge Riera Knorrenschild, et al. FOLFOX versus FOLFOX plus nivolumab and ipilimumab administered in parallel or sequentially versus FLOT plus nivolumab administered in parallel in patients with previously untreated advanced or metastatic adenocarcinoma of the stomach or GEJ. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4043).
- David Tougeron, Laetitia Dahan, Farid El Hajbi, et al. The PRODIGE 59-DURIGAST trial: A randomized phase II study evaluating FOLFIRI plus durvalumab and FOLFIRI plus durvalumab plus tremelimumab in second-line treatment of patients with advanced gastric or gastro-esophageal junction adenocarcinoma. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4036).
- Wen Zhang, Chun-Xia Du, Zhichao Jiang, et al. Perioperative chemotherapy with docetaxel plus oxaliplatin and S-1 (DOS) versus oxaliplatin plus S-1 (SOX) for locally advanced gastric or gastro-esophageal junction adenocarcinoma (MATCH): An open-label, randomized, phase 2 study. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4031).
- Thorsten Oliver Goetze, Ralf-Dieter Hofheinz, Harald Schmalenberg, et al. Perioperative ramucirumab in combination with FLOT versus FLOT alone for resectable esophagogastric adenocarcinoma (RAMSES/FLOT7) with high rate of signet cell component: Final results of the multicenter, randomized phase II/III trial. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4042).
- Ralf-Dieter Hofheinz, Kirsten Merx, Georg M Haag, et al. FLOT Versus FLOT/Trastuzumab/Pertuzumab Perioperative Therapy of Human Epidermal Growth Factor Receptor 2-Positive Resectable Esophagogastric Adenocarcinoma: A Randomized Phase II Trial of the AIO EGA Study Group. J Clin Oncol. 2022 Jun 16; JCO2200380.
- Salah-Eddin Al-Batran, Sylvie Lorenzen, Peter C. Thuss-Patience, et al. Surgical and pathological outcome, and pathological regression, in patients receiving perioperative atezolizumab in combination with FLOT chemotherapy versus FLOT alone for resectable esophagogastric adenocarcinoma: Interim results from DANTE. J Clin Oncol. 2022; 40 (suppl 16; abstr. 4003).
- Song Li, Qian Xu, Xin Dai, et al. Efficacy and toxicity of neoadjuvant immune checkpoint inhibitors in resectable gastric cancer: A meta-analysis and systematic review. ASCO GI 2022, abstr. 291.

