20.06.2022


В Чикаго с 3 по 7 июня 2022 года в гибридном формате состоялся конгресс Американского общества клинической онкологии (American Society of Clinical Oncology – ASCO). Более 2900 тезисов были отобраны для устного доклада и постерной сессии, а также более 2200 – для публикации онлайн. По теме рака молочной железы было опубликовано около 500 тезисов.
В данном обзоре приведены наиболее значимые результаты исследований, доложенных на заседаниях конгресса, которые касались вопросов противоопухолевой лекарственной терапии раннего рака молочной железы (рРМЖ).
Роль циркулирующей опухолевой ДНК при рРМЖ
Lipsyc-Sharf M. и соавт. представили результаты исследования CHiRP по изучению связи между уровнем циркулирующей опухолевой ДНК (цДНК) и поздним рецидивом при HR+ HER2-негативном раке молочной железы (РМЖ) высокого риска [1].
Согласно предыдущим исследованиям, обнаружение минимальной остаточной болезни (МОБ) с помощью цДНК связано с высоким риском рецидива РМЖ. Однако мало что известно о прогностической значимости цДНК в отношении позднего рецидива после адъювантного лечения при HR+ раке молочной железы [2].
В исследование было включено 83 пациента с HR+ РМЖ высокого риска и отсутствием признаков рецидива в течение 5 лет после постановки диагноза. Под высоким риском понимали категорию больных рРМЖ с:
Большая часть пациентов имели III стадию (68,7%), 90,4% получали адъювантную химиотерапию и все 100% пациенты – адъювантную эндокринную терапию.
С целью обнаружения цДНК плазмы была разработана диагностическая панель на основе первичной опухоли. Образцы плазмы для детекции цДНК собирали каждые 6-12 месяцев.
В общей сложности у 8 из 83 больных HR+ РМЖ высокого риска была обнаружена минимальная остаточная болезнь в виде циркулирующей опухолевой ДНК (МОБ). Из них у 6 пациентов с МОБ+ отдаленный рецидив развился в среднем через 37,6 мес. (медиана 12,4 мес.), тогда как у двух из восьми МОБ+ пациентов на момент последнего осмотра рецидива выявлено не было. Важно, что в исследовании у одного пациента без признаков минимальной остаточной болезни развился местный рецидив.
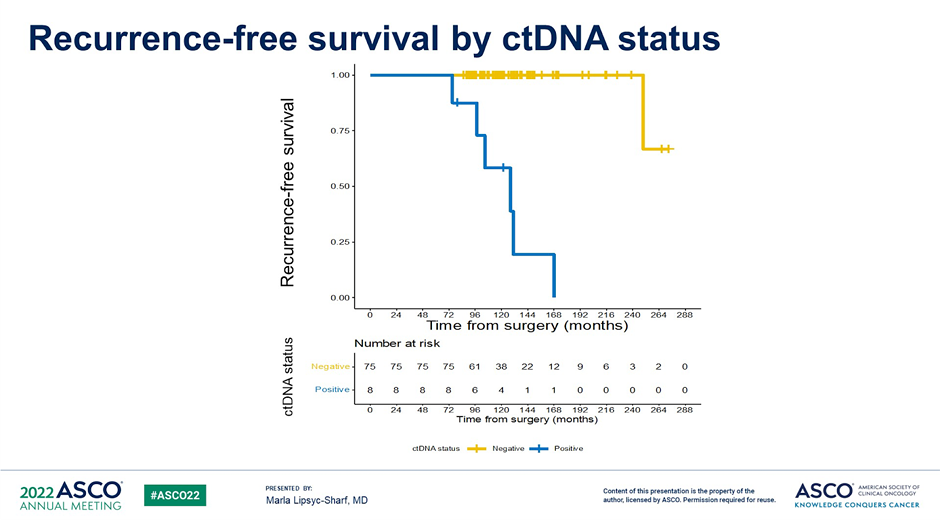
Рисунок 1. Исследование CHiRP: связь между поздним рецидивом и уровнем цДНК при HR+ HER2-негативном раке молочной железы высокого риска [1].
Адъювантная лучевая терапия при люминальном А подтипе рРМЖ
Адъювантная лучевая терапия обычно назначается пациенткам с РМЖ после органосохраняющей операции для снижения рисков местного рецидива [4]. Недавний ретроспективный анализ Liu F.F. и соавт. [5] исследования по изучению адъювантной ЛТ после органосохраняющей операции показал низкий риск рецидива (1,3%) у пациенток с люминальным А подтипом I стадии. Тем не менее, на сегодняшний день, в рамках проспективных исследований, не установлено, будет ли определение подтипа РМЖ влиять на принятие решения о проведении адъювантной лучевой терапии.
Whelan T.J. и соавт. представили результаты проспективного когортного исследования LUMINA по оценке риска местного рецидива без проведения адъювантной лучевой терапии у больных люминальным А подтипом рРМЖ низкого риска после органосохраняющей операции и эндокринной терапии [3].
В исследование LUMINA III фазы были включены 500 пациентов старше 55 лет, с люминальным А подтипом рРМЖ (ER ≥1%, PR >20%, HER2-отрицательный и Ki67 ≤13,25%), T1N0 стадии, Grade 1-2. Всем пациентам была проведена органосохраняющая операция без проведения адъювантной лучевой терапии. На ASCO 2022 были представлены 5-летние результаты данного исследования:
Данные результаты нуждаются в более длительном наблюдении, ведь риск локального рецидива продолжает увеличиваться после 5 лет, особенно в группе пациентов с люминальным А подтипом РМЖ [6].
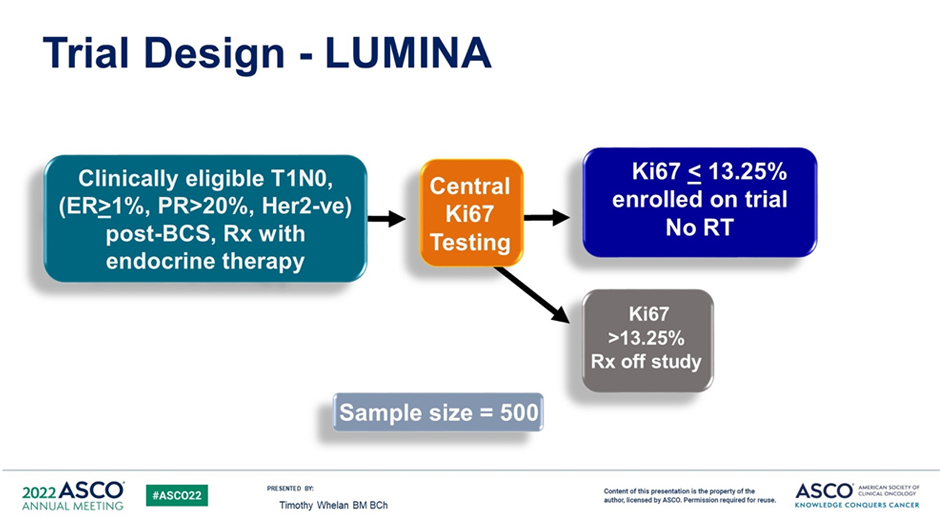
Рисунок 2. Дизайн проспективного когортного исследования LUMINA [3].
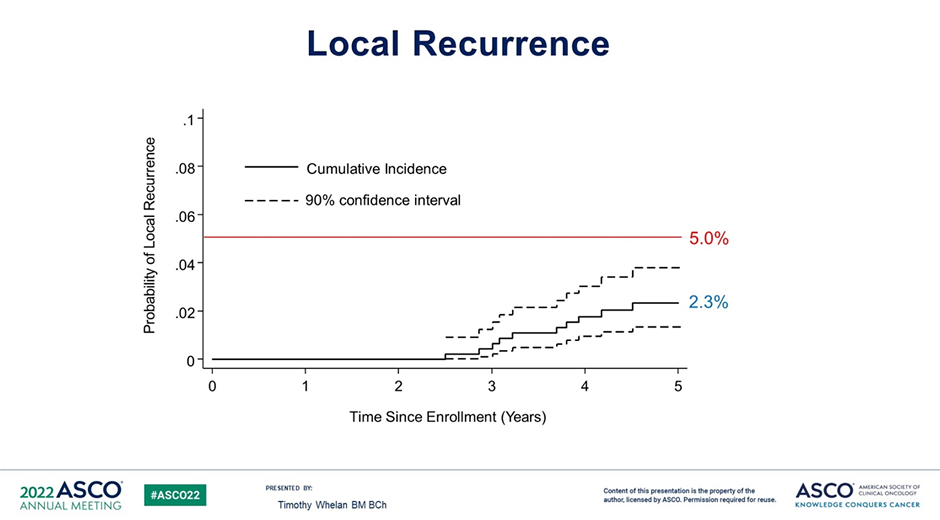
Рисунок 3. Частота локального рецидива в исследовании LUMINA [3].
Обновленные данные исследования KEYNOTE 522
В ходе конгресса Pusztai L. и сооавт. были озвучены обновленные результаты проспективного рандомизированного плацебо-контролируемого исследования 3 фазы KEYNOTE-522 по изучению иммунотерапии при раннем трижды-негативном раке молочной железы (ТНРМЖ) [7].
Напомним, что в данное исследование было включено 1174 пациента с ТНРМЖ II-III стадии, которые были рандомизированы для получения неоадъювантной терапии карбоплатином и паклитакселом с последующим назначением доксорубицина или эпирубицина и циклофосфамида в сочетании с пембролизумабом или плацебо. После оперативного лечения пациентам продолжали вводить пембролизумаб или плацебо каждые 3 недели в течение 9 циклов. Первичными конечными точками были полный патоморфологический ответ и бессобытийная выживаемость (БСВ).
При четвертом промежуточном анализе авторы оценили связь БСВ с патоморфологическим ответом по RCB (Residual Cancer Burden). Через 36 месяцев БСВ в исследовании составила 76,8% в группе плацебо и 84,5% в группе пембролизумаба. Статус RCB-0 был достигнут у 63,4% в группе пембролизумаба и 56,2% пациентов в группе плацебо. Отношение рисков для бессобытийной выживаемости с RCB-0 составило 0,70 (95% ДИ 0,38-1,31), для RCB-1 – 0,92 (95% ДИ 0,39-2,20); для RCB-2 – 0,52 (95% ДИ 0,32-0,82); а для RCB-3 – 1,24 (95% ДИ 0,69-2,23).
Данный поданализ показал, что у пациентов из группы RCB-2 с умеренно выраженным остаточным заболеванием наблюдалось значительное улучшение БСВ при добавлении пембролизумаба. Тем ни менее, необходимо осторожно интерпретировать эти данные, так как количество наблюдений в каждой группе в зависимости от RCB было небольшим, особенно в группе RCB-1 и RCB-3. Будущее исследование SWOG S1418 поможет ответить на вопрос о необходимости добавления адъювантной иммунотерапии у пациентов с остаточной опухолью.
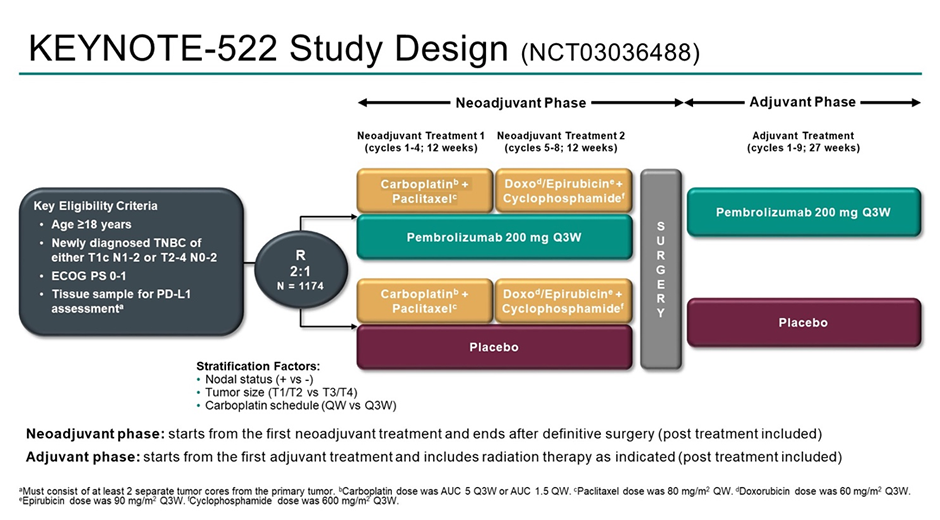
Рисунок 4. Дизайн проспективного рандомизированного плацебо-контролируемого исследования 3 фазы KEYNOTE-522 [7].
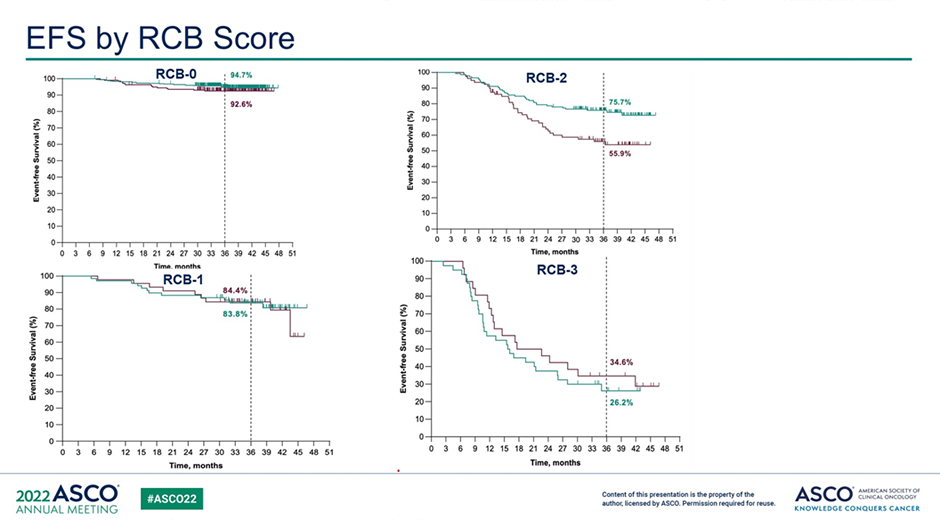
Рисунок 5. Результаты БСВ в зависимости от уровня RCB в исследовании KEYNOTE-522 [7].
Биоаналог трастузумаба TX05 при раннем раке молочной железы
Разработка первого таргетного препарата трастузумаб произвела революцию в лечении HER2+ РМЖ. Однако высокая стоимость биологически направленных таргетных препаратов может препятствовать более широкому доступу пациентов к оптимальному лечению. Внедрение биоаналогов в терапевтический арсенал потенциально может облегчить доступ к эффективным методам лечения РМЖ.
Криворотько П.В. и сооавт. представили результаты исследования 3 фазы TX05-03, в котором сравнивалась эффективность и безопасность биоаналога трастузумаба TX05 с оригинальным трастузумабом у пациентов с HER2+ ранним РМЖ [8].
Ранее на конгрессе ESMO 2021 были доложены данные по первичной конечной точке pCR, где биоаналог TX05 не уступал оригинальному трастузумабу в эффективности. Частота pCR составила 48,8% в группе биоаналога TX05 и 45,3% в группе трастузумаба (ОР 1,0783; 95% ДИ 0,92-1,27) [9].
На ASCO исследователи представили теперь уже отдаленные результаты исследования. Выживаемость без прогрессирования, общая выживаемость и безопасность были сопоставимы для биоаналога и оригинального препарата.
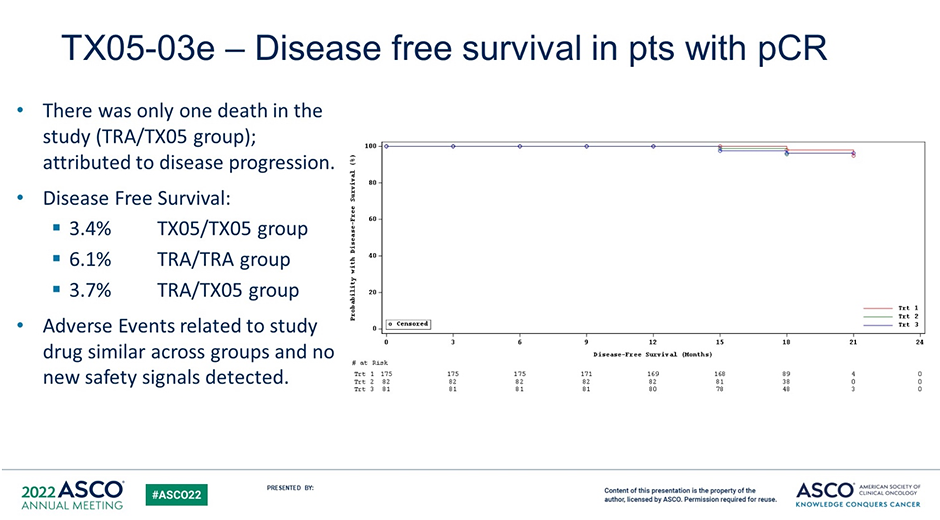
Рисунок 6. Исследование TX05-03: биоаналог трастузумаба TX05 против оригинального трастузумаба. Представлены данные по ВБП [8].
Отдаленные результаты адъювантной терапии деносумабом при рРМЖ
Gnant M. и сооавт. представили заключительные данные рандомизированного контролируемого исследования ABCSG-18, в котором ранее было продемонстрировано увеличение времени до первого клинического перелома у больных рРМЖ, получавших деносумаб в дозе 60 мг каждые 6 месяцев во время адъювантной терапии ингибиторами ароматазы [10].
Безрецидивная выживаемость (БРВ) составила 69,0% в группе плацебо и 74,4% в группе деносумаба (ОР 0,83; 95% ДИ 0,71-0,97; p=0,02) после медианы наблюдения 8 лет. Показатели выживаемости без костных метастазов составили 81,3% в группе плацебо и 85,7% в группе деносумаба соответственно (ОР 0,81; 95% ДИ 0,65-1,00; p=0,05). Общая выживаемость составила 83,6% в группах плацебо и 88,8% в группе деносумаба (ОР 0,80; 95% ДИ 0,63-1,01; p=0,06) [11].
Не было отмечено новых случаев токсичности, а также ни одного случая остеонекроза челюсти в течение периода исследования, что может быть связано с низкой дозой деносумаба.
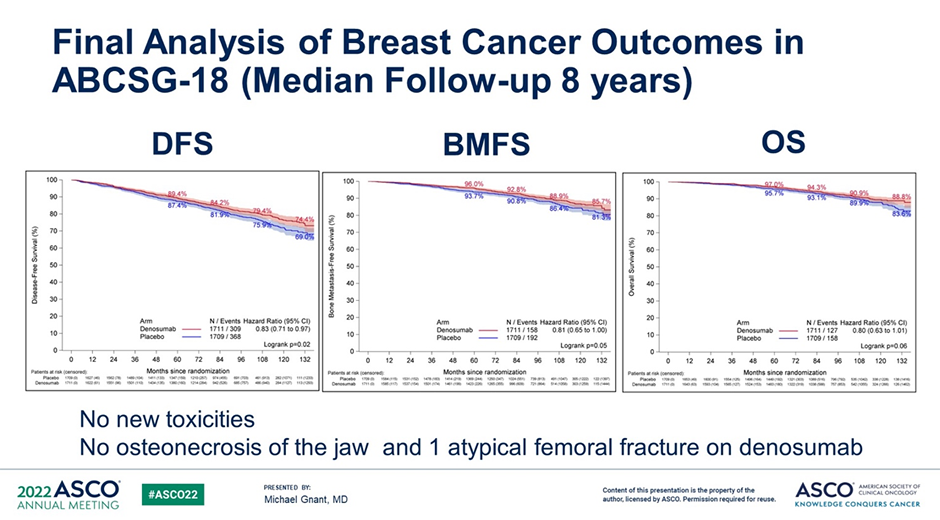
Рисунок 7. Результаты БРВ, выживаемости без костных метастазов и ОВ в исследовании ABCSG-18 [11].
Список литературы: