Новости онкологии
20.05.2022
Новые рекомендации ASTRO по ведению пациентов с метастатическим поражением головного мозга
Шейко Андрей Владимирович
Заведующий радиотерапевтическим отделением №2, врач-радиотерапевт, ГБУЗ ВО «Областной клинический онкологический диспансер», Владимир
В мае 2022 года Американское общество радиационной онкологии (ASTRO) опубликовало новые клинические рекомендации по ведению пациентов с метастатическим поражением головного мозга [1]. Примечателен тот факт, что гайдлайны ASTRO, посвященные данной непростой категории пациентов, не обновлялись без малого десять лет. В опубликованном руководстве обсуждены аспекты, касающиеся современных методов лучевой терапии (стереотаксическая радиохирургия (SRS), лучевая терапия всего объема головного мозга с исключением гиппокампа), а также возможностей современной системной терапии.
Рабочая группа ASTRO попыталась дать ответы на четыре ключевых вопроса:
- показания к SRS как к единственному методу лечения интактных метастазов в головной мозг;
- показания к пред- и послеоперационной SRS, облучению всего объема головного мозга (ОВГМ) или наблюдению при резецированных ранее метастазах в головной мозг;
- показания к ОВГМ при интактных метастазах в головной мозг;
- определение рисков симптоматического радионекроза при ОВГМ и/или SRS.
Вопрос 1
- SRS в монорежиме рекомендована всем пациентам в состоянии ECOG 0-2 при наличии интактных метастазов в головной мозг в количестве не более четырех (уровень убедительности рекомендаций (УУР) – сильный, качество доказательств – высокое).
- SRS также условно рекомендована пациентам в состоянии ECOG 0-2 при наличии интактных метастазов в головной мозг в количестве от 5 до 10 (УУР – условный, качество доказательств – низкое).
- При диаметре метастатического очага менее 2,0 см рекомендована однократная SRS в дозе 20-24 Гр. В случае высокого риска радионекроза (например, при превышении дозного ограничения в 12 Гр на 10 см3 объема паренхимы головного мозга (весь объем интактного головного мозга плюс (!) таргетные очаги) при планировании однократной SRS возможно принятие решения в пользу проведения фракционированной SRS в режиме 27 Гр/3 фракции или 30 Гр/5 фракций (УУР – сильный, качество доказательств – среднее).
- При диаметре метастатического очага ≥2,0 см, но <3,0 см условно рекомендована однократная SRS в дозе 18 Гр. В случае высокого риска радионекроза при планировании однократной SRS возможно принятие решения в пользу проведения фракционированной SRS в режиме 27 Гр/3 фракции или 30 Гр/5 фракций (УУР – условный, качество доказательств – низкое).
- При диаметре метастатического очага ≥3,0 см, но <4,0 см условно рекомендована фракционированная SRS в режиме 27 Гр/3 фракции или 30 Гр/5 фракций. В случае выбора однократной SRS может быть использована доза 15 Гр. В случае имеющегося масс-эффекта, независимо от диаметра метастаза, необходим мультидисциплинарный подход с участием нейрохирурга и решением вопроса о возможности нейрохирургического пособия (УУР – условный, качество доказательств – низкое).
- При диаметре метастатического очага >4,0 см условно рекомендовано нейрохирургическое лечение, при невозможности – фракционированная SRS. В условиях дефицита клинических данных SRS при диаметре метастаза >6,0 см не рекомендуется (УУР – условный, качество доказательств – низкое).
- Локальное лечение метастатических очагов в качестве первого этапа (при выполнении описанных выше условий) рекомендовано всем пациентам с симптомными метастазами, кому планируется дальнейшая системная лекарственная терапия (УУР – сильный, качество доказательств – низкое).
- При бессимптомном метастатическом поражении головного мозга в случае планирования тропной к ЦНС системной терапии условно рекомендован мультидисциплинарный подход, ориентированный на качество жизни пациента, с обязательной оценкой безопасности отсрочки локальных методов лечения. При этом должны быть учтены такие факторы, как размеры и количество метастазов, их расположение в паренхиме головного мозга, вероятность ответа на системную терапию, доступность тщательного нейроонкологического наблюдения и методов сальважной терапии (УУР – условный, качество доказательств – мнение эксперта).
При локализации метастатических очагов в непосредственной близости от высокоприоритетных критических структур (ствол головного мозга, зрительные тракты) возможно снижение предписанной дозы SRS или преднамеренный дефицит дозного покрытия таргетных очагов. Однако следует учитывать, что более выраженный локальный контроль наблюдается при достижении биологически эффективной дозы в очаге (BED10) ≥50 Гр (из расчета α/β метастатического очага = 10 Гр).
Очередность локальных методов лечения и системной терапии, воздействующей на ЦНС, или иммунотерапии (анти-PD-1 или анти-CTLA4) до сих пор не определены ввиду отсутствия убедительных данных рандомизированных исследований. Ранее в рекомендациях ASCO-SNO-ASTRO, опубликованных в Journal of Clinical Oncology также в 2022 году [2], сообщалось о возможности отсрочить локальное лечение пациентам с интракраниальными бессимптомными метастазами:
- EGFR-позитивного немелкоклеточного рака легкого (НМРЛ) при назначении осимертиниба;
- ALK-позитивного НМРЛ при назначении алектиниба/бригатиниба/церитиниба;
- BRAF-V600-позитивной меланомы при назначении дабрафениба + траметиниба;
- меланомы (независимо от BRAF-статуса) при назначении ниволумаба + ипилимумаба;
- HER2-позитивном раке молочной железы, спрогрессировавшем после терапии трастузумабом, пертузумабом и/или трастузумаб эмтанзином, при назначении комбинации трастузумаба + тукатиниба + капецитабина.
Во всех вышеперечисленных случаях локальное лечение метастазов в головной мозг может быть отсрочено до появления признаков интракраниального прогрессирования (УУР – слабый, качество доказательств – низкое).
Вопрос 2
- С целью улучшения локального контроля всем пациентам с резецированными метастазами в головной мозг рекомендована лучевая терапия (SRS или ОВГМ) (УУР – сильный, качество доказательств – высокое).
- С целью сохранения нейрокогнитивных функций и качества жизни пациентам с резецированными метастазами и ограниченным количеством интактных метастазов рекомендован отказ от ОВГМ в пользу SRS (УУР – сильный, качество доказательств – среднее).
- В качестве возможной альтернативы послеоперационной SRS пациентам с резектабельными метастазами условно рекомендовано проведение предоперационной SRS (УУР – условный, качество доказательств – низкое).
Рекомендованные ASTRO дозы однократной послеоперационной SRS представлены в таблице 1. Учитывая неправильную форму хирургических полостей, однократная SRS возможна лишь при максимальном диаметре полости <5,0 см. С целью снижения риска развития радионекроза возможно также использование фракционированной SRS, однако убедительных рекомендаций по дозным режимам, подтвержденных результатами рандомизированных исследований, пока не представлено. Одноцентровые исследования, рассматривающие фракционированную SRS, нередко имеют результатом публикацию внутреннего протокола лечения, что может оказаться подспорьем для выбора режима облучения при невозможности однократной SRS (например, протокол лечения метастатического поражения головного мозга Онкологического центра принцессы Маргарет [3]).
Таблица 1. Дозные режимы однократной послеоперационной SRS.
| Объем послеоперационной полости |
Доза однократной SRS |
| <4,2 см3 | 20 Гр |
| ≥4,2 до <8,0 см3 | 18 Гр |
| ≥8,0 до <14,4 см3 | 17 Гр |
| ≥14,4 до <20,0 см3 | 15 Гр |
| ≥20,0 до <30,0 см3 | 14 Гр |
| ≥30,0 см3 до <5,0 см max | 12 Гр |
Вопрос 3
- В случае невозможности проведения нейрохирургического лечения и/или SRS пациентам с метастазами в головной мозг при благоприятном прогнозе (оцененном по Прогностической шкале общей выживаемости при метастатическом поражении головного мозга в зависимости от первичного диагноза [4]) рекомендовано ОВГМ (30 Гр/10 фракций) (УУР – сильный, качество доказательств – высокое).
- При планировании ОВГМ пациентам группы благоприятного прогноза рекомендовано исключение гиппокампа из объема облучения. Исключение гиппокампа нецелесообразно лишь в случае локализации метастатического очага в непосредственной близости от гиппокампальной зоны или в случае лептоменингеального характера метастазирования (УУР – сильный, качество доказательств – высокое).
- При проведении ОВГМ или ОВГМ с исключением гиппокампа рекомендовано назначение мемантина (1-я неделя – 5 мг каждое утро; 2-я неделя – 5 мг каждое утро и вечер; 3-я неделя – 10 мг каждое утро и 5 мг каждый вечер; 4-24-я недели по 10 мг утром и вечером во время и после проведения ОВГМ) (УУР – сильный, качество доказательств – низкое).
- Проведение ОВГМ после SRS пациентам группы благоприятного прогноза с ограниченным количеством метастазов не рекомендовано. ОВГМ в дополнение к SRS возможно для усиления интракраниального контроля (например, при множественных рецидивирующих метастазах в головной мозг и/или высокой скорости метастазирования в головной мозг), а также в условиях ограниченного доступа пациента к тщательному динамическому наблюдению (например, невозможность выполнения МРТ каждые 2-3 месяца в течение первого года) и к быстрому началу сальважного лечения (нейрохирургии или SRS) (УУР – сильный, качество доказательств – высокое).
- Пациентам группы неблагоприятного прогноза рекомендовано раннее начало симптоматического и паллиативного лечения для контроля над неврологическими симптомами. При принятии решения в пользу ОВГМ более предпочтительно использование ускоренных режимов облучения (20 Гр/5 фракций) (УУР – сильный, качество доказательств – среднее).
Вопрос 4
- При планировании однократной SRS превышение дозного ограничения в 12 Гр на 10 см3 объема паренхимы головного мозга (весь объем интактного головного мозга плюс таргетные очаги) не рекомендовано во избежание симптоматического радионекроза. При невозможности выполнить ограничение V12Гр ≤10 см3 рекомендовано рассмотреть фракционированную SRS (УУР – условный, качество доказательств – низкое).
До сих пор остается дискутабельным вопрос комбинации лекарственной терапии (например, ингибиторами тирозинкиназы) и SRS. Данные, появляющиеся в ходе немногочисленных исследований, противоречивы в отношении вклада подобных комбинаций в развитие радионекроза.
Графическое описание клинических сценариев для пациентов с ограниченным количеством метастазов в головной мозг представлено на рисунке 1, для пациентов с более массивным поражением головного мозга – на рисунке 2.
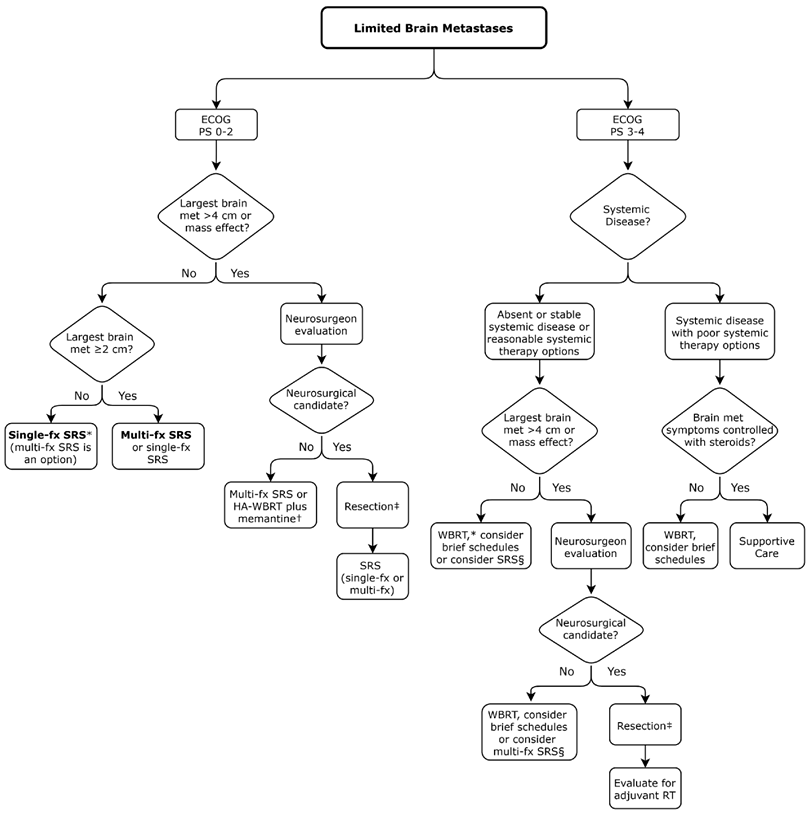
Рисунок 1. Рекомендации по ведению пациентов с ограниченным количеством метастазов в головной мозг.
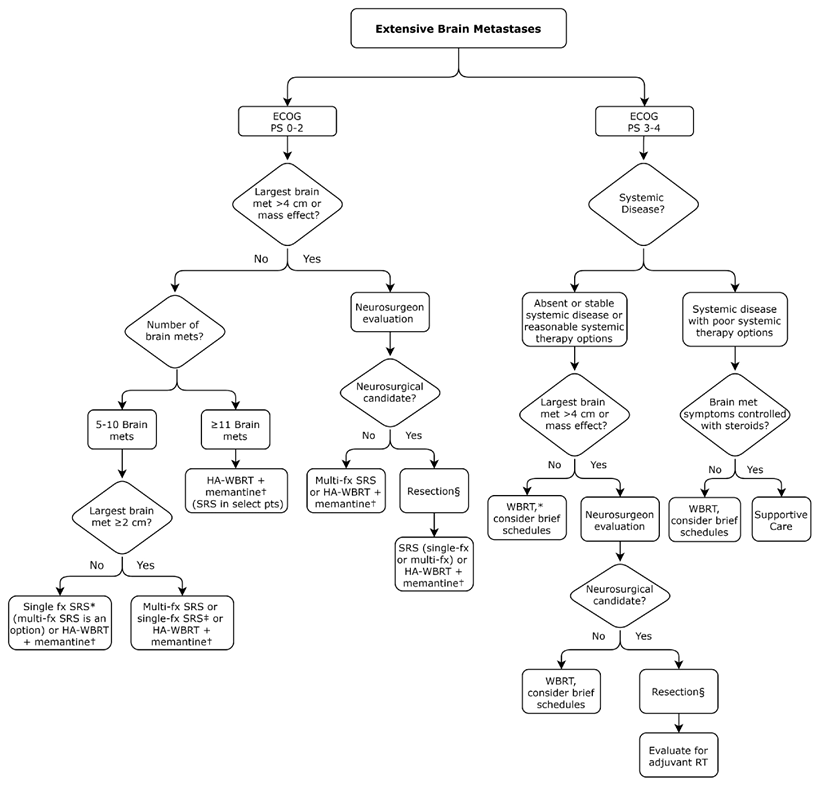
Рисунок 2. Рекомендации по ведению пациентов с распространенным метастатическим поражением головного мозга.
Список литературы:
- Gondi V, Bauman G, Bradfield L, et al. Radiation Therapy for Brain Metastases: An ASTRO Clinical Practice Guideline [published online ahead of print, 2022 May 6]. Pract Radiat Oncol. 2022; S1879-8500(22)00054-6. doi:10.1016/j.prro.2022.02.003.
- Vogelbaum MA, Brown PD, Messersmith H, et al. Treatment for Brain Metastases: ASCO-SNO-ASTRO Guideline [published correction appears in J Clin Oncol. 2022 Apr 20; 40(12): 1392. J Clin Oncol. 2022; 40(5): 492-516. doi:10.1200/JCO.21.02314.
- Princess Margaret Cancer Centre Clinical Practice Guidelines. Central Nervous System, Brain metastases. 2019.
- reference.medscape.com/calculator/357/brain-metastases-prognostic-index.


