12.01.2022

Современная радиотерапия не приемлет разрывов в лечении. Потеря локального контроля за каждый незапланированный пропущенный день лечения сейчас ни у кого не вызывает сомнений. Однако реальность такова, что радиационным онкологам все чаще приходится сталкиваться с вынужденной остановкой радикального курса лучевой или химиолучевой терапии, например, в связи с инфицированием пациента COVID-19. Очень важным при этом является поиск грамотного баланса между риском высокой раково-специфической смертности ввиду отсрочки лечения и риском смертности от инфекционных интеркуррентных заболеваний при их незавершенном лечении или недостаточном периоде реабилитации [1]. Коронавирусная инфекция – лишь одна из многих причин, приводящих к вынужденной остановке в лечении.
Подливает масла в огонь и тот факт, что зачастую предельно важной оказывается общая продолжительность лечения. Так, при раке анального канала общая продолжительность терапии более 41 дня ставит под угрозу 5-летний локальный контроль независимо от того, включало ли лечение перерыв или нет (демпинг 5-летнего локального контроля составляет 12% для опухолей T1-2 и 31% при T3-4 [2,3]). Связь между общей продолжительностью лечения и его исходами при прочих плоскоклеточных раках (ОГШ, шейка матки, рак легкого) также неопровержима. Демпинг локального контроля может достигать 1-2% за каждый день продления времени терапии. Таким образом, в моделях плоскоклеточного рака пролонгация лечения означает потерю эффекта от 0,4-0,6 Гр за каждый пропущенный день [4]. К примеру, при злокачественных опухолях головы и шеи как короткие (4-8 дней), так и более длительные задержки в лечении (>8 дней) приводят к снижению абсолютной четырехлетней общей выживаемости на 4% и 12% (р<0,0001) соответственно [5].
Все онкологические пациенты могут быть условно разделены на следующие категории приоритета (определяющий фактор – потенциальное время удвоения опухолевых клеток Tpot) [6]:
Основные причины разрыва в лечении:
Методы профилактики разрывов в лечении:
Рекомендации по компенсации разрыва курса лучевой терапии представлены в таблице 1 [6,7].
Таблица 1. Методы компенсации разрыва курса лучевой терапии.
| Метод | Преимущества | Потенциальные трудности |
|---|---|---|
| Лечение в выходные дни | Возможность не выбиться из запланированных сроков лечения и запланированной СОД | Неприменимо для разрыва лечения в конце запланированного курса |
| Лечение 2 раза в день | См. выше | Высокий риск поздних лучевых осложнений при частом использовании двухфракционной схемы или при недостаточном временном интервале между фракциями (менее 6 часов) |
| Эскалация СОД на количество дней, равное разрыву в лечении | Возможность не выбиться из запланированных сроков лечения при сохранении прежнего ритма облучения 1 раз в день | Неприменимо для уже запланированных режимов гипофракционирования. Возможно негативное влияние на терапевтический индекс в связи с повышением риска поздних лучевых осложнений со стороны органов риска (при попытке компенсаторной эскалации СОД) или в связи с «недооблучением» первичной опухоли (при попытке соблюсти толерантость органов) |
| Эскалация СОД с укорочением количества фракций после разрыва | См. выше | См. выше |
| Принять неизбежность удлинения общего времени лечения и использовать эскалацию СОД для его минимизации | Хотя бы частичное восстановление изначально запланированного курса | Негативное влияние на терапевтический индекс: необходимо смириться с неизбежным снижением локального контроля и повышением риска поздних лучевых осложнений |
| См. пункт 5, но с использованием облучения 2 раза в день с небольшим итоговым удлинением общего времени лечения | См. выше | Негативное влияние на терапевтический индекс может быть не столь выраженным |
Алгоритм действий в случае состоявшегося разрыва в лечении напрямую зависит от кинетики и радиобиологии опухоли. Принципиальное значение имеет понимание таких показателей, как α/β опухоли, Tk или Tlag (время до ускоренной репопуляции/задержка роста опухоли), Tpot (потенциальное время удвоения опухолевых клеток), К-фактор (доза, эффект которой на репопуляцию клеточной массы «утрачен» за каждый 1 день разрыва лечения). Основные параметры, принимаемые во внимание при компенсации доз, представлены в таблице 2 [8].
Таблица 2. Параметры кинетики и радиобиологии опухолей при компенсаторном пересчете доз лучевой терапии.
| Тип ЗНО | α/β опухоли (Гр) | К-фактор (Гр за 1 день) | Tlag (дни) |
|---|---|---|---|
| Плоскоклеточные раки (в т.ч НМРЛ и аденокарцинома легкого)* | 10 Гр | 0,9 | 28 |
| Переходно-клеточные раки | 10 Гр | 0,36 | 35 |
| Аденокарцинома молочной железы (послеоперационная ЛТ) | 4 Гр | 0,6 | 21 |
| Аденокарцинома молочной железы (первичная) | 4 Гр | 0,3 или 0,6 (при перерыве >42 дней) | 21 42 |
| Аденокарцинома предстательной железы (высокодифференцированная) | 2 Гр | 0,3 | 42 |
| Аденокарцинома предстательной железы (умеренно- и низкодифференцированная) | 4 Гр | 0,5 | 42 |
| Прочие аденокарциномы | 4 Гр | 0,3 | 42 |
| Прочие ЗНО первой категории приоритета | 10 Гр | 0,9 | 28 |
* Для данного типа опухолей при коротких гипофракционированных режимах возможно использование К-фактора 0,36-0,6 Гр/день после перерыва в 21 день; при еще более коротких режимах (например, при плоскоклеточном раке кожи) предлагается использовать К-фактор = 0,15 Гр/день после перерыва в 14 дней.
Алгоритм действий в случае состоявшегося разрыва в лечении:
рассчитать BED (биологическую эффективную дозу) для нормальных тканей на весь период запланированного курса по формуле
где N – количество запланированных фракций, d – доза за фракцию, рекомендуемое α/β – 3 Гр (для спинного мозга – 2 Гр);
рассчитать BED на опухоль с учетом продления сроков лечения по формуле
где Т – общая продолжительность лечения, Tdelay – время от начала лечения до начала ускоренной репопуляции, К – К-фактор;
Таким образом, расчет компенсаторных доз при незапланированных перерывах в курсе лучевой терапии – процесс довольно сложный и трудоемкий. Попытки с помощью арифметических манипуляций «протиснуться» в терапевтическое окно между клинической пользой и осложнениями довольно часто грозят оказаться бесполезными и бессмысленными, особенно при плоскоклеточных раках с высоким α/β. Для некоторых опухолей до сих пор недостаточно убедительных данных об их кинетике (например, для рака анального канала величина К-фактора по разным данным литературы колеблется от 0,4 до 0,9 Гр). Перерыва в лечении и, как следствие, удлинения общего времени терапии необходимо избегать всеми возможными способами для сохранения адекватного локального контроля, безрецидивной выживаемости и других показателей. Компенсация перерыва в лечении при радикальном курсе лучевой терапии зачастую сомнительна по эффективности и чревата большим количеством ошибок и негативными последствиями на терапевтический индекс. Вклад химиотерапевтического компонента в биологию и кинетику рака также недостаточно убедительно изучен, поэтому расчет BED для опухоли и нормальных тканей в случае компенсаторного лечения может быть весьма затруднителен.
Источники:

Радиотерапевты, работающие более 7-8 лет по специальности, прекрасно помнят, как регулярно администрация учреждений по результатам годовых отчетов «строгала» нас за чрезмерно превышенный койко-день в радиологическом отделении. Пресловутый койко-день являлся неким почти безукоризненным, по мнению организаторов здравоохранения, показателем полноты и качества догоспитального обследования, организации работы отделения и адекватности оказываемой помощи. Этот показатель требовалось постоянно снижать – только не понятно, до каких нулей. По какой-то не укладывающейся в наших радиотерапевтических головах причине считалось, что чем меньше пациент пребывает на койке, тем правильнее лечат в данном отделении – и это при том, что помимо традиционных режимов фракционирования лучевой терапии, подразумевающих несколько недель лечения, рекомендованные руководствами, укороченные курсы применялись лишь в паллиативных целях. Гипофракционирование было робким, SBRT и СИБы (симультанные интегрированные бусты) – в зачаточном состоянии, а дозволенное гиперфракционирование укорачивало курс лишь на чуть. Появление нового оборудования, усложнение предлучевой подготовки, сложности оконтуривания и планирования и вовсе сделало уменьшение койко-дня невыполнимой задачей.
Что приходилось делать для поддержания «подобающего» по длительности койко-дня, дабы не навлечь на себя гнев вышестоящих контролирующих структур? Правильно, снижать его искусственно, выписывая пациентов, даже еще не закончивших полностью радикальный курс, делая перерыв, якобы, для купирования лучевых реакций, для «отдыха» пациента после завершения 1 этапа и т.д. Хорошо, если выписка происходила под выходные, и перерыв составлял не более 2-3 дней. В нынешних условиях, когда пациент перед каждой госпитализацией должен приносить целый список свежих анализов, в том числе и тех, которые делаются несколько дней, и пациент рискует пропасть на недели или даже месяцы по различным причинам, в т.ч. и причине ковида, подобная практика выглядит не просто бессмысленной – но и губительной. В тех центрах, где эту проблему осознают врачи и осведомленная администрация, отделения радиотерапии продолжают функционировать и облучать пациентов и в официальные нерабочие дни, включая гипертрофированные новогодние праздники, делая все, чтобы курс был непрерывным. И радиотерапевты, и администрация, и пациенты, и их родственники должны осознавать, что радикальный курс лечения должен быть завершен без перерывов, возможно, ценой более выраженных осложнений и необходимой поддерживающей терапии. Что 45 Гр при раке анального канала или 50 Гр при ОГШ – это не некий завершенный «1 этап радикального курса», а лишь его обломок, способный при последующем перерыве длительностью более 3 дней свести на нет все предыдущие усилия и полностью скомпрометировать как непосредственные, так и отдаленные результаты.
В качестве иллюстрации – данные крупного анализа из NCDB по результатам лечения больных местнораспространенным НМРЛ методом одновременной ХЛТ по протоколу (без перерывов) и с перерывами различной длительности. Число пациентов, включенных в анализ, впечатляет – 14154, из которых 6262 (44,2%) лечились с перерывами. Достаточно взглянуть на график (см. рисунок) и понять, насколько серьезно разрывы в лечебном курсе, даже, казалось бы, небольшие, достоверно укорачивают общую выживаемость больных НМРЛ.
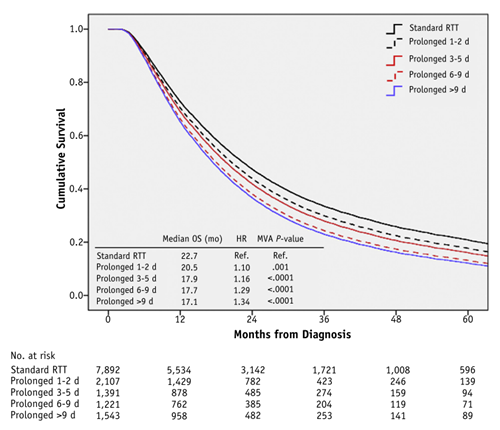
Рисунок. Влияние перерывов в радикальном курсе лучевой терапии (в днях) на выживаемость больных [1].
Статья доктора Шейко, на мой взгляд – это не только напоминание о губительном влиянии перерывов в лечении на непосредственные и отдаленные результаты, но и практическое руководство к действию. Поскольку RUSSCO уже давно является сообществом, объединяющим представителей различных специальностей, включая немалое число радиотерапевтов, мы посчитали эту публикацию на сайте необходимой. Правильное построение плана радикальной ЛТ/ХЛТ и адекватное ведение пациентов, которые потенциально могут быть излечены от опухоли или иметь длительную ремиссию, жизненно важно, и каждый из нас, их врачующих, должен это осознавать.
Источник: McMillan MT, et al. Radiation Treatment Time and Overall Survival in Locally Advanced Non-small Cell Lung Cancer. Int J Radiation Oncol Biol Phys. 2017; 98(5): 1142-1152.