23.11.2021


2021 год был богат на ожидаемые (и не очень) результаты клинических исследований и события в онкологическом мире, и именно поэтому выбрать из них что-то наиболее важное было очень непросто. Но, как нам кажется, результаты исследования DREAMseq, посвященного, казалось бы, чисто практическому вопросу (выбору оптимальной последовательности лечебных опций у больных BRAF-мутированной меланомой), делают это исследование одним из самых важных событий уходящего 2021 года. Все дело в том, что это не просто исследование о последовательности терапии – это прямое сопоставление двух «революционных» платформ лечения – иммунотерапии и таргетной терапии. Ведь несмотря на то, что уже достаточно долго постулируется принципиальное различие таргетной терапии (ТТ) и иммуноонкологических препаратов (ИО), заключающееся в паллиативном действии первых и, возможно, излечивающем (хотя бы для части пациентов) действии вторых, прямого подтверждения этому не было. А в связи с этим не было и единого мнения о том, какой из вариантов лечения является предпочтительным, так как при непрямом сравнении результаты обоих подходов выглядели «достойно» и вполне сопоставимо.
В исследование было включено 265 пациентов, имеющих распространенную меланому с мутацией BRAF V600E, ранее не получавших системного лечения (за исключением адъювантной терапии интерфероном). Большинство пациентов (около 90%) имели стадию M1, у 40% включенных больных был повышен уровень ЛДГ, при этом стадию M1c имели около 60%, у 30% статус по ECOG был равен 1. Больные рандомизировались 1:1 на получение в качестве первичного лечения комбинации ипилимумаб (3 мг/кг)/ниволумаб (1 мг/кг) 4 введения за 12 недель, с последующей поддерживающей терапией ниволумабом (3 мг/кг) каждые 2 недели (максимально 72 недели) или терапию дабрафениб/траметиниб в стандартном режиме до прогрессирования или непереносимой токсичности. В случае прогрессирования предусматривался «перекрест» – пациенты переходили на вариант терапии, предусмотренный для другой группы.
Инициальная терапия сопровождалась практически одинаковой частотой достижения ремиссий – 46% в группе, получавшей ИО препараты, и 43% в группе, начавшей ТТ. Однако во второй линии, после перекреста, частота достижения объективного ответа на ИО препараты была ниже – 30% против 48% для ТТ. Это оказалось единственным показателем эффективности, где ИО «проиграла» ТТ. Более того, отчасти это также подтверждало «суммарный» вывод исследования – начинать у этих пациентов следует с ИО препаратов (т.к. непосредственная эффективность их во 2 линии оказывается ниже, чем у ТТ, а в первой линии она сопоставима).
При этом, несмотря на одинаковую частоту достижения ремиссий в первой линии терапии, длительность ответа на лечение была значимо выше у больных, получающих ИО препараты (медиана не достигнута против 12,7 месяца в группе ТТ, р<0,001; рис.1).
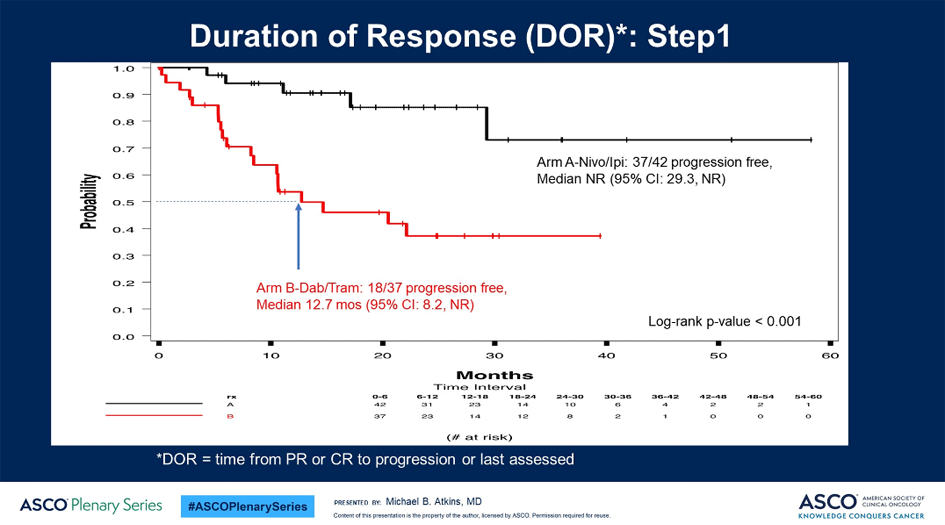
Рисунок 1. Продолжительность ответа на терапию (1 линия).
Несмотря на относительно небольшое число больных в группах, достигших объективного эффекта (42 в группе ИО и 37 в группе ТТ), это первое прямое сравнение, свидетельствующее о явном преимуществе ИО препаратов в отношении длительности эффекта при лечении диссеминированной меланомы, а длительное сохранение «плато» свидетельствует о том, что для части пациентов, скорее всего, речь действительно может идти о пожизненном эффекте (а в лучшем случае – об излечении). Выживаемость без прогрессирования также оказалась (хотя и не статистически значимо, р=0,054) выше в группе ИО препаратов. За счет более «позднего» расхождения кривых медианы выживаемости различались не очень впечатляюще – 8,8 месяца для ТТ против 12,8 месяца для ИО, однако двухлетняя ВБП различалась вдвое, составив 19% против 42% соответственно.
Но основным результатом исследования, безусловно, является значимое различие в общей выживаемости. Абсолютное преимущество в 2-летней общей выживаемости группы, начавшей терапию с ИО препаратов, составило 20%: 72% против 52% при старте с ТТ (р=0,0094; рис.2).
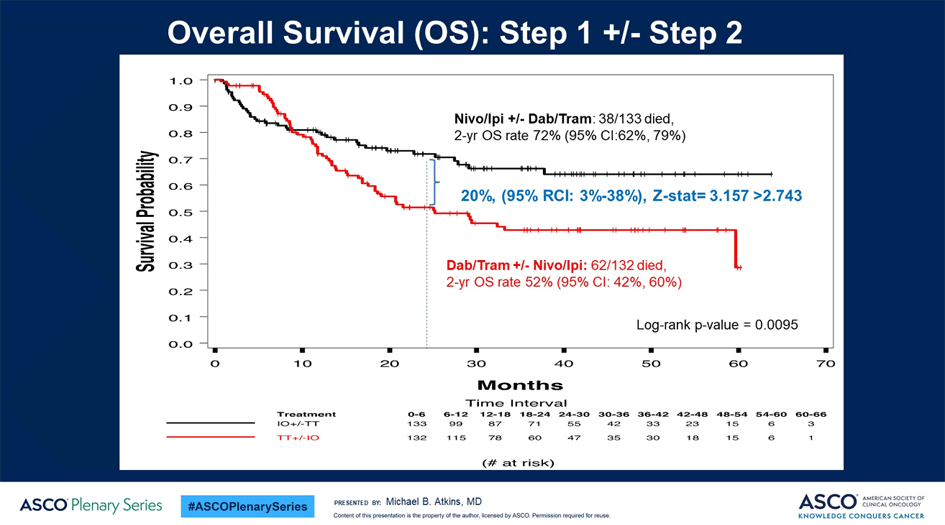
Рисунок 2. Показатели общей выживаемости при использовании ТТ и ИО на старте.
Авторы особо обратили внимание на наличие «перекреста» кривых общей выживаемости, когда в первые 10 месяцев кривая ТТ находилась выше, чем ИО кривая. Отчасти это ожидаемая ситуация, связанная со скоростью (а не вероятностью) развития эффекта от ИО и ТТ, что и подтвердилось при анализе данных – большинство пациентов, погибших в первые 10 месяцев терапии ИО препаратами, имели быстро прогрессирующие опухоли, т.к. ни один не успел получить 2 линию лечения. Второй причиной являлась ранняя и, хотя и не смертельная, но препятствующая продолжению любого лечения токсичность ИО препаратов (хорошо известная для комбинации, предусматривающей введение ипилимумаба в дозе 3 мг/кг). Медиана длительности терапии 24 больных, погибших в первые 10 месяцев от начала лечения в группе ИО препаратов, составила менее 6 недель (т.е. пациенты успели получить лишь 1-2 введения препаратов). К сожалению, выделить подгруппу пациентов, имеющих высокий риск ранней смерти на фоне ИО препаратов, не удалось – для риска ранней тяжелой токсичности это вряд ли вообще возможно, в отношении раннего прогрессирования суммарные результаты лечения оказались выше в группе ИО препаратов вне зависимости от пола, возраста, распространенности заболевания, уровня ЛДГ, статуса по ECOG. Однако даже принимая во внимание этот риск ранней неудачи, суммарный эффект оказался впечатляющим: старт с ИО позволял дополнительно каждому 5-му пациенту пережить 2-летний рубеж, а формирование «плато» кривой ОВ группы, получавшей ИО препараты, свидетельствует о том, что этот выигрыш сохранится и при увеличении срока наблюдения. Подобный выигрыш с нашей точки зрения полностью оправдывает начало лечения этих пациентов именно с комбинированной ИО терапии, хотя и требует дополнительных усилий по выявлению популяции пациентов, для которых, возможно, необходимо временное назначение ТТ с последующим переходом на ИО препараты до прогрессирования или использование комбинации ИО + ТТ.
А что же по поводу теоретического вопроса о принципиальном различии действия ИО и ТТ (в отношении излечения)? С нашей точки зрения, кривые длительности эффекта дают обоснованную надежду на то, что так оно и есть. Однако, безусловно, для однозначного суждения необходим больший срок наблюдения. В отношении же общей выживаемости – скорее всего, имеет место суммация различных причин. Здесь речь идет не только о том, что для части больных ИО оказались эффективней при использовании в качестве инициального лечения, но и о том, что при прогрессии ситуация меняется с точностью до наоборот – ТТ за счет более быстрого противоопухолевого эффекта в состоянии «подхватить» пациента, дав ему пусть и паллиативный, но длительный эффект, в то время как ИО препараты при использовании у пациентов, уже получивших ТТ, гораздо менее эффективны.
Что дает это исследование для клинициста? В первую очередь, уверенность в выборе в пользу начала терапии с комбинированной ИО у пациентов с BRAF-мутированной меланомой за исключением ситуации, требующей быстрого противоопухолевого эффекта (аналог «висцерального криза», описанного для рака молочной железы). Но и в случае начала с ТТ переключение на ИО не по факту прогрессирования болезни (медиана времени до прогрессирования 8-9 месяцев), а намного раньше, после купирования признаков «висцерального» криза.
Дополнительно возникает вопрос о выборе варианта инициальной терапии у пациентов, ранее получавших ТТ в адъювантном режиме, а также сроке безрецидивного промежутка, позволяющего ожидать ответ на ТТ, назначаемую уже при распространенной болезни. Нам еще только предстоит ответить на этот и многие другие вопросы.
Результаты исследования DREAMseq (NCT02224781) – это первый, пусть пока еще и очень маленький, но серьезный шаг к формированию новых принципов терапии пациентов с BRAF-мутированной меланомой, позволяющий изменить судьбу пусть пока и части, но уже значимой, больных с абсолютно фатальным ранее заболеванием.
Источник: Michael B. Atkins, Sandra J. Lee, Bartosz Chmielowski, et al. DREAMseq (Doublet, Randomized Evaluation in Advanced Melanoma Sequencing): A phase III trial – ECOG-ACRIN EA6134. J Clin Oncol. 2021; 39 (suppl 36; abstr 356154).