27.10.2021

Рак легкого по-прежнему занимает первое место по заболеваемости и смертности среди онкологических заболеваний и у женщин, и у мужчин в мире. Немелкоклеточный рак легкого (НМРЛ) составляет приблизительно 84% [1] среди всех злокачественных опухолей легкого.
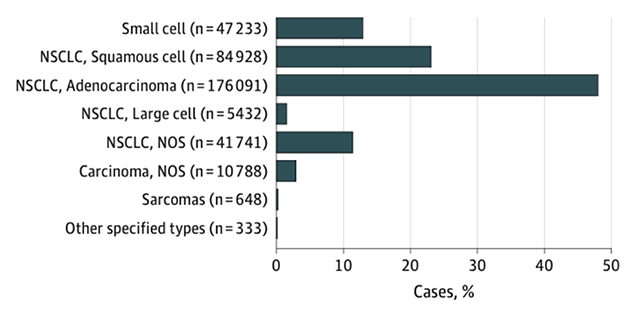
Рисунок 1. Соотношение различных морфологических вариантов рака легкого [1].
Несмотря на успехи диагностики и внедрение скрининговых программ, практически половина всех случае рака легкого приходится на IV cтадию [2].
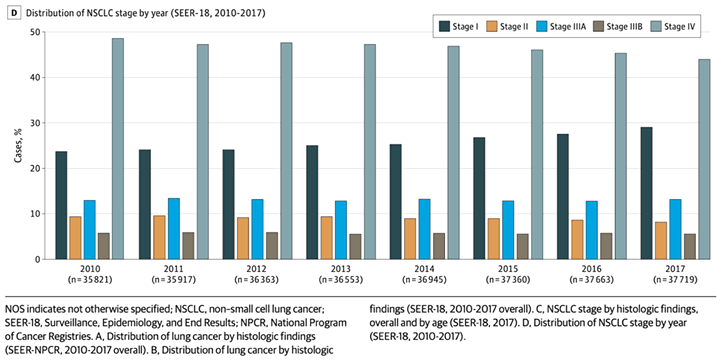
Рисунок 2. Соотношение всех впервые выявленных случаев рака легкого по стадиям [2].
С внедрением молекулярно-генетических методов диагностики, появлением таргетной терапии, появлением иммунотерапии лекарственное лечение метастатического НМРЛ драматически изменилось [3]. В настоящее время мы выделяем множество биологически совершенно разных опухолей, которые объединены исключительно локализацией, и подходы к лечению принципиально отличаются: плоскоклеточные раки (ассоциированные с курением, с большой мутационной нагрузкой и высоким потенциалом ответа на иммунотерапию или комбинацию химиоиммунотерапии), аденокарциномы с драйверными мутациями, где есть высоко эффективные опции таргетной терапии, аденокарциномы различного строения и другие формы НМРЛ лечатся по-разному.
При этом до сих пор в лечении местнораспространенного неоперабельного рака легкого используется «one size fits all» подход, где вне зависимости от гистологической и молекулярно-биологической структуры стандартном лечения является химиолучевая терапия.
Большим прорывом в лечении немелкоклеточного местнораспространенного рака легкого стало исследование PACIFIC, которое оценивало эффективность применения ингибитора PD-L1 дурвалумаба в качестве поддерживающей терапии у пациентов с местнораспространенным неоперабельным НМРЛ после проведенной химиолучевой терапии. По данным финального анализа исследования [4], медиана безрецидивной выживаемости увеличилась в три раза с 5,6 до 16,9 мес. Другой, не менее важный показатель эффективности терапии, особенно в контексте иммунотерапии, – это выживаемость на определенной временной точке. Безрецидивная выживаемость (БРВ) на отметке 60 месяцев составила 19,0% в группе плацебо против 33,1% в экспериментальной группе. Это значит, что каждый третий пациент не прогрессировал в течение 5 лет, получая дурвалумаб. Общая выживаемость (ОВ) к 5 годам была 33,4% в группе плацебо против 42,9% в экспериментальной группе. При этом медиана (ОВ) была 47,5 мес. в группе дурвалумаба против 29,1 мес. в группе плацебо. На основании этого исследования стандартом лечения местнораспространенного рака легкого стала химиолучевая терапия с последующей поддерживающей терапией дурвалумабом в течение 1 года.
При этом, как и в других исследованиях с иммунотерапией, не все группы пациентов одинаково выигрывали от проводимой поддерживающей иммунотерапии. Наибольшее преимущество отмечено у пациентов с экспрессией PD-L1 >25% (HR 0,41) и пациентов без драйверной мутации EGFR (HR 0,47). Также стоит отметить, что только 8% в исследовании не курили, что говорит о том, что в исследование были включены пациенты с большим потенциалом чувствительности к иммунотерапии [5].
Данные исследования PACIFIC были подтверждены и исследованием реальной клинической практики. На конгрессе ESMO 2021 года были доложены результаты исследования PACIFIC-R, где дурвалумаб использовался уже не в рамках клинического исследования, а в программе раннего доступа для того, чтобы оценить эффективность поддерживающей терапии у более неоднородной группы пациентов. В финальный анализ исследования было включено 1399 пациентов из нескольких центров Европы [6]. Медиана БРВ в этом исследовании была даже больше, чем в исследовании PACIFIC, – 21,7 против 16,9 мес., 12-месячная и 24-месячная БРВ составили 62,4% и 48,2% соответственно.
Несмотря на очень убедительные данные этих исследований, назначение дурвалумаба в качестве поддерживающей терапии остается недооцененным. По данным анализа страховых выплат Medicare и Medicaid в США, несмотря на то, что дурвалумаб был одобрен с 2018 года, лишь 23% и 36% пациентов получали поддерживающую терапию этим препаратом [7]. С чем это связано, остается не до конца ясным.
Дурвалумаб одобрен в качестве поддерживающей терапии в Российской Федерации как после одновременного химиолучевого лечения, так и после последовательного, однако поддерживающая иммунотерапия на территории РФ применяется нечасто. Большой проблемой остается невысокая частота химиолучевой терапии у этой группы пациентов.
В исследовании PACIFIC чуть меньше половины пациентов (44,5%) имели IIIB стадию НМРЛ легкого, а у 52,9% отмечена IIIA стадия. Хирургическое лечение не рассматривается у пациентов с IIIB и IIIC cтадиями, и основой лечения становится сочетание химио- и лучевой терапии. При этом IIIA стадия – это одна из самых разнородных и сложных для лечения групп пациентов.
Именно поэтому мультидисциплинарное обсуждение, в котором равноценно участвуют торакальные хирурги, химиотерапевты, морфологи, радиотерапевты и специалисты по лучевой диагностике – неотъемлемая часть эффективного лечения.
Одна крайность IIIA стадии – это bulky disease, или массивное поражение лимфоузлов средостения, когда изначально опухоль неоперабельна. У этих пациентов, скорее всего, решение будет принято в пользу химиолучевого лечения.
Другая категория пациентов с IIIA стадией – это случаи патоморфологической «находки», когда клиническая стадия была ниже, но по результатам планового морфологического исследования было выявлено N2 поражение лимфатических узлов. Это та группа больных НМРЛ, которые чаще всего идут по пути хирургического лечения, а затем адьювантной химиотерапии. В адъювантной терапии НМРЛ длительное время была стагнация. Адъювантная химиотерапия на основе цисплатина добавляет 5-10% общей выживаемости, но, к сожалению, ее могут перенести далеко не все пациенты [8].
Колоссальным прорывом стало применение осимертиниба в качестве адъювантной таргетной терапии у пациентов IB-IIIA стадии EGFR мутированного НМРЛ после хирургического лечения (± адъювантная химиотерапия). Исследование было настолько очевидно позитивным, что по решению независимого комитета оно было завершено раньше запланированного анализа. На конгрессе ASCO 2021 были доложены феноменальные результаты исследования ADAURA [9]. К отметке 24 месяца 90% пациентов, получавших осимертиниб, не имели прогрессирования, в то время как в группе плацебо без признаков прогрессирования были лишь 44% больных. Фантастическими были не только цифры БРВ, но и такой важный показатель, как прогрессирование в головной мозг. Метастатическое поражение ЦНС – это один из самых сложных сайтов прогрессирования, который зачастую определяет прогноз заболевания. К 24 месяцам 98% пациентов были живы и без метастазов в ЦНС, в то время как в группе плацебо без метастазов в головной мозг к 2 годам было только 85% пациентов. Подгрупповой анализ показал эффективность осимертиниба вне зависимости от стадии заболевания, в том числе и при IB стадии, вне зависимости от вида мутации (del19ex vs L858R) и вне зависимости от того, получали ли пациенты адъювантную химиотерапию.
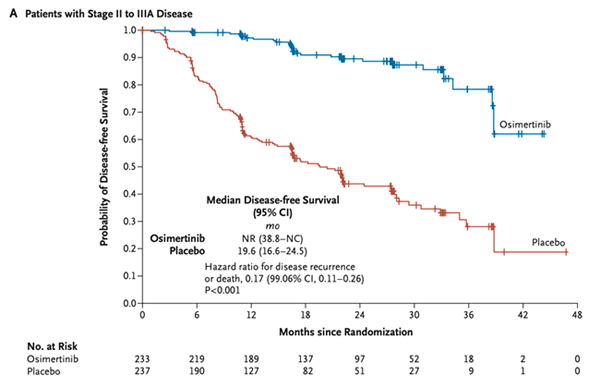
Рисунок 3. ВБП при применении осимертиниба у больных с НМРЛ с мутацией EGFR по данным исследования ADAURA [9].
Следующим большим прорывом адъювантной терапии НМРЛ стало исследование IMpower 010, которое оценивало эффективность адъювантной терапии атезолизумабом после радикального хирургического лечения у пациентов с IB-IIIA стадией рака легкого [10]. В это исследование также включались пациенты с драйверными мутациями. Иерархический дизайн исследования сначала предусматривал оценку первичных конечных точек у пациентов с положительной PD-L1 экспрессией с II-IIIA стадией, а в случае достижения этой первичной конечной точки статический анализ расширялся сначала на общую популяцию пациентов с II-IIIA стадией, а затем и до целой популяции в исследовании (ITT). Исследование оказалось позитивным: безрецидивная выживаемость увеличилась на 11,8% (с 48,2% до 60%) в точке 36 месяцев у PD-L1 позитивных пациентов с II-IIIA стадией (p=0,04). Увеличение БРВ было отмечено и в общей популяции пациентов (в том числе и PD-L1 негативных), однако в подгрупповом анализе видно, что для этой группы больных HR составляет 0,92, что говорит, вероятно, об отсутствии преимуществ у этих пациентов. Два метода расчета подгруппового анализа (включая и исключая пациентов с драйверными мутациями) позволяют нам сделать вывод, что наличие мутации EGFR или ALK «сдвигает» HR в пользу плацебо.
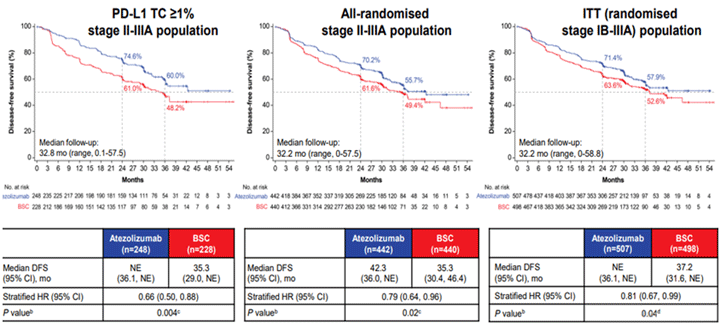
Рисунок 4. ВБП у больных с II-IIIA стадией НМРЛ и PD-L1 экспрессией ≥1%, всех рандомизированных пациентов с II-IIIA стадией и всей популяции больных, пролеченных по схеме (данные исследования IMpower 010).
На основании данных этого исследования FDA зарегистрировало атезолизумаб в качестве адъювантной терапии у пациентов с позитивной PD-L1 экспрессией, перенесших хирургическое лечение и платиносодержащую адъювантную химиотерапию [11].
Но есть и промежуточная группа больных, достаточно большая, где объем операции на первом этапе представляется слишком травматичным или вовсе невозможным, но при этом есть потенциал для хирургического вмешательства в случае ответа опухоли на лечение, которое может улучшить результаты этого лечения. Для этих пациентов достижение глубокого ответа на лечение позволит уменьшить объем операции (с пневмонэктомии до лобэктомии), для них проведение неоадъювантной химиотерапии – это реальный шанс на излечение.
Эта группа пациентов в течение длительного времени оставалась недооцененной, потому что эффективных опций для неоадъювантной химиотерапии НМРЛ было мало.
В метаанализе 15 исследований по неоадъювантной терапии для II-IIIA стадии немелкоклеточного рака легкого разница в ОВ в группах составила 5%, что сопоставимо с исследованиями адъювантной химиотерапии, которые проводились в это же время [12].
В 2014 году было предложено использовать суррогатную конечную точку MPR (major pathological response, или наибольший патоморфологический ответ) в качестве оценки эффективности неоадъювантной химиотерапии. Этот показатель, как и pСR, коррелирует с БРВ и ОВ [13]. Учитывая феноменальную эффективность как моноиммунотерапии (у пациентов с высокой PD-L1 экспрессией), так и комбинированной химиоиммунотерапии [14] у пациентов с метастатическим НМРЛ, следующим шагом была попытка использования этих режимов у пациентов в качестве неоадъювантной терапии.
Исследование СheckMate 816 оценивало эффективность добавления ниволумаба к 3 циклам химиотерапии до хирургического лечения. В исследовании не включались пациенты с драйверными мутациями. Первичными конечными точками в этом исследовании стали pCR и БРВ. Добавление ниволумаба к химиотерапии увеличило частоту pСR с 2,2% до 24,0%. Частота MPR (наибольший патоморфологический регресс, при котором остается менее 10% жизнеспособной опухолевой ткани) увеличилась с 8,9% до 36,9% [15].
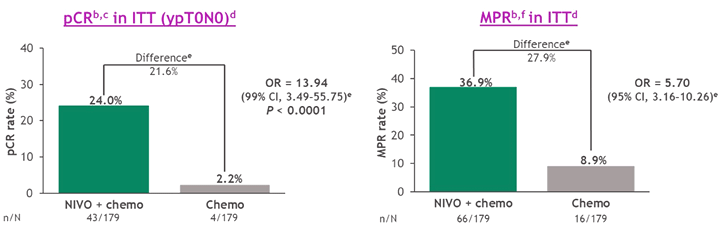
Рисунок 5. Частота полных (pCR) и наибольших (MPR) патоморфологических регрессов опухоли по данным исследования СheckMate 816 [15].
Несмотря на интенсификацию лечения в экспериментальной группе, частота побочных явлений не увеличилась, более того, среднее время хирургического вмешательства было меньше в группе с ниволумабом: 169-186 минут против 210-218 минут в группе плацебо. Частота послеоперационных осложнений, длительность госпитализации были одинаковы в обеих группах. Добавление ниволумаба также позволило снизить частоту пневмонэктомий у пациентов с IIIA стадией. Пневмонэктомия была у 30% пациентов в группе плацебо против 17% в группе ниволумаба. Результаты БРВ будут доложены в скором времени.
На наших глазах большой клубок проблем, касающихся опухолей легкого, начинает распутываться. И мы видим, что это десятки абсолютно разных, не похожих друг на друга нитей. Сегодня мы не можем лечить рак легкого в отрыве от его биологии и клинического контекста.
В настоящее время идут исследования NEOADAURA (NCT04351555) по неоадъювантной терапии осимертинибом, LAURA (NCT03521154) по таргетной терапии после лучевой терапии для EGFR мутированного местнораспространенного НМРЛ. Группа исследований ALCHEMIST использует концепцию корзиночных исследований таргетных препаратов для пациентов, у которых есть драйверные мутации [16]. Параллельно продолжаются исследования с неоадъювантной и адъювантной химиоиммунотерапией.
На мой взгляд, наиболее эффективные опции лечения должны использоваться на более ранних этапах. Наша задача, в первую очередь, помочь как можно большему числу пациентов. Очевидно, что для больных с драйверными мутациями будущее за неоадъювантной и/или адъювантной таргетной терапией. Для курящих пациентов с ранним НМРЛ, где хирургическое лечение нетравматично, опцией могут быть разные варианты адъювантной химиоиммунотерапии. А для пациентов с местнораспространенным раком легкого, где хирургическое лечение на первом этапе неоправданно, безусловно, свое место займет неоадъювантная химиоиммунотерапия.
Единый подход в лечении местнораспространенного рака легкого постепенно сменяется подходом «biology driven», когда имея высокоэффективные опции лечения для разных биологических формы опухоли, мы можем их применять на разных этапах лечения, помогая большему числу пациентов.
Источники: