19.10.2021

...Играют ли они какую-либо роль в развитии локальных рецидивов или метастазировании? Нужно ли воздействовать (оперировать, облучать) на парастернальную зону при инвазивном раке молочной железы? Эти вопросы стоят перед научным онкологическим сообществом и практикующими врачами уже не одно десятилетие.
Согласно данным лимфосцинтиграфии, основной отток лимфы от всех квадрантов молочной железы идет в подмышечные лимфоузлы (около 85%), на парастернальные приходится около 15%, а надключичные лимфоузлы принимают лимфу из всех зон. Считается, что при внутренней или центральной локализации опухолей идет прямое дренирование непосредственно в парастернальные лимфоколлекторы в 44% случаев [1]. Но даже при позитивных сигнальных подмышечных лимфоузлах далеко не всегда эта зона оказывается вовлеченной, лишь в 8-27% [2]. Однако по данным, полученным в целой серии исследований (более 5000 пациентов), в том числе проспективных, по проведению расширенной мастэктомии с парастернальной лимфодиссекцией, частота поражения парастернальных лимфоузлов строго ассоциирована с поражением подмышечных лимфоузлов и может достигать чуть ли не 52% при позитивных лимфоузлах подмышечной зоны с преимущественным поражением коллекторов первых 2 межреберий [3] – но имеет ли такая высокая частота вовлечения какое-либо клиническое значение?
Данные 3 рандомизированных исследований по сравнению результатов радикальной мастэктомии по Холстеду с расширенной мастэктомией (с удалением парастернальных лимфоузлов), опубликованные в 1980-90-х годах, не выявили каких-либо преимуществ расширенной операции, после чего подобный подход был практически полностью забыт [2]. В настоящее время нет никаких рекомендаций в отношении того, что мы должны совершать диагностический поиск для выявления парастернальных лимфоузлов (проводить КТ грудной клетки, прицельную биопсию, ПЭТ, лимфосцинтиграфию парастернальной зоны и т.д.). Отношение к профилактическому воздействию (облучению) на внутренние грудные лимфоузлы также долгое время оставалось прохладным. Одно дело, если имеются веские данные о метастатическом поражении этой зоны, полученные каким-либо методом визуализации или подтвержденные биопсией: тогда это реальная опухоль, теоретически и потенциально способная к росту и метастазированию. Другое дело, если облучать с профилактической целью, держа в голове возможность наличия микрометастазов в парастернальных лимфоузлах, то есть некое опасение, что эти лимфоузлы без какого-либо локального воздействия станут причиной большой катастрофы. Основные выводы многих исследований 1980-2000-х годов по облучению парастернальной зоны сводились к следующему: эффект воздействия сомнителен, а вот грань между возможным выигрышем и риском осложнений слишком тонка. И лишь преимущественное применение более старых технологий не позволяет причислить подобные работы к числу весомых, учитывающих все нынешние реалии (биологические подтипы опухоли, лекарственная терапия и т.д.). Тем не менее, в рекомендациях крупных онкологических сообществ на рубеже веков конкретной информации о том, как действовать в отношении парастернальных лимфоузлов, не было. Эксперты предлагали практикующим врачам решать самостоятельно, возможно, ориентируясь на собственный опыт или традиции центра.
Традиции оказались разнообразны, как следует из результатов опроса Taghian et al. 2004 года [4]. Практикующим специалистам – радиационным онкологам – из Европы (435 респондентов) и Северной Америки (702) было предложено ответить на вопросы о показаниях к облучению парастернальной зоны при разных клинических сценариях – после мастэктомии или резекции, с 1-3 пораженными лимфоузлами или 4 и более, с наличием экстракапсулярной инвазии или без нее. Оказалось, что подходы значительно различались даже в пределах Европы: так, если во Франции и Бельгии парастернальная зона включалась в объем облучения практически во всех ситуациях, то в Великобритании – почти никогда. Ориентироваться, кто из них более прав, было невозможно. На курсах по доказательной радиационной онкологии от ESTRO в качестве очевидных представляли следующие факты:
Решение на протяжении десятилетий было отдано на откуп радиотерапевту, призванному тщательно взвешивать все за и против, все риски и преимущества – однако, согласитесь, имея столь зыбкие основания из доказательной базы, сложно иметь четкие ориентиры. Вот поэтому так сильно ожидались исследования, способные оценить вклад облучения парастернальной зоны в отдаленные результаты лечения больных с инвазивным раком молочной железы.
Они появились практически одновременно, в начале прошлого десятилетия, вот только публикации несколько припозднились. Дизайн канадского исследования МА20 и европейского EORTC 22922/10925 [6,7] был схож: пациентки после органосохраняющей операции или мастэктомии и адъювантного лекарственного лечения рандомизировались в группу расширенного облучения (молочная железа/грудная стенка + надподключичные и парастернальные лимфоузлы) или лучевой терапии только на молочную железу или грудную стенку. Авторы французского исследования [7] отнеслись более избирательно к проблеме выбора предмета рандомизации: сравнение проводилось между группами, где в поле облучения включались либо грудная стенка и надключичные лимфоузлы, либо добавлялось еще и парастернальное поле. Вскоре после публикации результатов этих исследований появился и их метаанализ – настолько долгожданны они были [8].
В итоге канадское и европейское исследования продемонстрировали схожие результаты – преимущество добавления облучения зон лимфоузлов: плюс 3-5% к выживаемости без прогрессирования, плюс 3-4% к выживаемости без отдаленных метастазов и тенденция (без достижения достоверности) к улучшению общей выживаемости (+1-1,6%). Французское исследование каких-либо преимуществ избирательного добавления парастернального поля не выявило. Тем не менее, метаанализ трех исследований торжественно присудил победу расширенному облучению региональных зон: ВБП HR 0,85, выживаемость без отдаленных метастазов HR 0,82, OВ HR 0,88. Однако, когда отзвучали аплодисменты, появились вопросы и сомнения, да немало.
Самое главное: разница в результатах была действительно невелика (3-5%). В любых иных ситуациях даже бо́льшая разница могла бы быть расценена как «отсутствие различий». Влияние на ОВ не доказано (+1-1,6% без достижения достоверности). По данным исследований МА20 и EORTC было невозможно оценить, за счет чего случился выигрыш, какая зона облучения внесла наибольший вклад в улучшение показателей – именно парастернальная или все же надключичная, или обе вкупе. В канадском исследовании МА20 среди всех больных с развившимся регионарным рецидивом 63% рецидивов зарегистрированы в подмышке и 27% – в надключичной зоне. Ни одного рецидива в парастернальной зоне не было отмечено, несмотря на то, что подавляющее большинство пациентов имели N+ (90%). В исследовании EORTC 22922 частота рецидивов в парастернальных лимфоузлах как была низкой без облучения (0,8%), так и осталась таковой после лучевой терапии (0,2%). Если предположить, что расширение объемов облучения имело бы выигрыш у больных с большим размером первичной опухоли и более массивным поражением лимфоузлов (а следовательно, и более высоким риском метастазов в парастернальной зоне), то результаты EORTC не поддерживают данную мысль. Чем больше была первичная опухоль, чем массивнее поражение лимфоузлов, тем меньше отмечено пользы от облучения регионарных зон; очевидно, отнюдь не лучевая терапия играет первую скрипку в подобных ситуациях, а лекарственное лечение. Наконец, отсутствие преимуществ добавления парастернального поля во французском исследовании оставляет осадок неудовлетворенности. Тем не менее, в рекомендациях NCCN 2016 года появилась обтекаемая фраза «если есть показания к облучению, то рекомендовано рассмотреть необходимость добавления парастернального поля». При этом большинство экспертов St.Gallen 2015 года по-прежнему не рекомендовали облучение парастернальной зоны.
Пока продолжалось бурное обсуждение результатов трех исследований, по отдельности и совокупно, сомнения в отношении вклада парастернальной зоны в общее дело улучшения результатов оставалось у многих. Итальянские авторы Dellapasqua et al. в своем ретроспективном анализе сопоставили результаты лечения 107 больных с верифицированными метастазами в надключичных (n=42) либо парастернальных (n=65) лимфоузлах с основной целью: оценить прогностическое значение данных клинических ситуаций в схожих когортах пациентов, но без подтвержденного поражения этих зон лимфоузлов [9]. Больные были хорошо распределены в группы по возрасту, TNM, стадии процесса, даже по биологическим подтипам (большинство имели люминальные раки), все они получали стандартное лечение, в том числе и лучевую терапию на региональные зоны (она была проведена у подавляющего большинства пациенток).
Даже будучи ретроспективными, данные оказались весьма показательными. Пятилетняя ВБП составила 84% в группе с метастазами в парастернальных лимфоузлах против 38,8% у пациентов с вовлечением надключичной зоны (P<0,0001), а 5-летняя общая выживаемость оказалась почти вдвое лучше – 96,9% против 57,1% (P<0,0001). При этом никакой разницы в отдаленных результатах между пациентами с верифицированными метастазами в парастернальных лимфоузлах и без оных не отмечено (5-летняя ОВ 96,9% против 93,5%, P=0,897; 5-летняя ВБП 84% против 76,5%, P=0,729; локорегиональные рецидивы за 5 лет – 6,2% против 5,1%, P=0,801; частота отдаленных метастазов за 5 лет 6,7% против 12,8%, P=0,423), тогда как в случае с надключичной зоной эта разница была значительна и часто достоверна (5-летняя ВБП 38,8% против 58,9%, P=0,041; ЛРР за 5 лет 22,6% против 8,6%, P=0,048), тренд в сторону различий в 5-летней ОВ (57,1% против 78%, P=0,068) и кумулятивной частоте отдаленного метастазирования за 5 лет (32,9% против 24,9%, P=0,511). Основной вывод, сделанный авторами, – именно вовлечение надключичных лимфоузлов коррелирует с худшим прогнозом в отличие от поражения парастернальной зоны.
Но в 2016 году явились датчане со своим новым видением того, быть или не быть облучению внутренних грудных лимфоузлов, и со своим элегантным дизайном проспективного популяционного исследования: пациенткам с правосторонней локализацией опухоли проводилось облучение парастернальной зоны, а с левосторонней – нет [10]. Основными конечными точками были общая выживаемость, раково-специфичная смертность и частота отдаленных метастазов. В отличие от исследования EORTC, где почти половина больных имели N0, все пациенты из датского DBCG-IMN (n=3086) имели N+, а медиальные или центральные локализации опухоли отмечены более чем у 1/3 пациенток. И датчанам впервые удалось достичь статистически достоверного улучшения ОВ за 5 лет при облучении парастернальной зоны (75,9% против 72,2%) и снижения раково-специфической смертности (20,9% против 23,4%). При этом подгрупповой анализ показал, что наибольшее значение облучение имеет в случае медиальной/центральной локализации опухоли в сочетании с N+, а также при латеральной локализации при поражении 4 и более лимфоузлов. Для наиболее частой клинической ситуации – латеральная опухоль, N1 – добавление парастернального поля не давало преимуществ (рис.1).
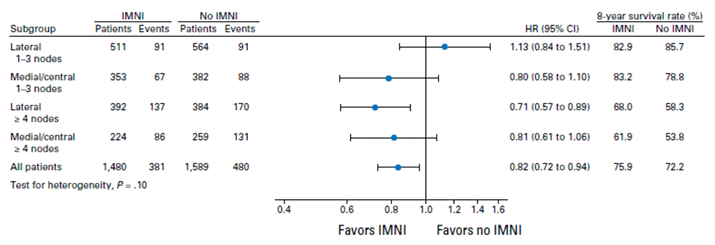
Рисунок 1. Подгрупповой анализ исследования DBCG-IMN.
Несмотря на столь небольшую разницу в результатах (приблизительно в 3%), мнение экспертов NCCN и St.Gallen к 2017 году изменилось. St. Gallen 2017: было рекомендовано рассмотреть отказ от облучения регионарных зон при N1 и отсутствии отягощающих факторов риска – и облучать при их наличии (возраст 40 лет и менее, низкая экспрессия ЭР и ПР либо рецептор-негативные опухоли, G3, обширная лимфоваскулярная инвазия) и >3 позитивных л/узлов. NCCN 2.2017: показано облучение региональных зон при 4 и более позитивных лимфоузлах (включать парастернальную зону!), рассмотреть необходимость их облучения при 1-3 лимфоузлах (включая парастернальную зону) и при N0 – рассмотреть необходимость региональных зон при медиальной/центральной локализации опухоли.
Однако сомнения оставались. К примеру, если пристально рассмотреть технические аспекты лучевой терапии всех 4 исследований, то можно отметить: все они имеют технические различия в отношении объемов мишени (в частности, в МА20 облучали 1-3 межреберные промежутки, тогда как во французском – с 1 по 5), методик планирования и облучения (только 2D в EORTC и французском и 3D в МА20; в датском допускалось и то, и другое) и т.д. Ни в одном из исследований не применялась 3D конформная лучевая терапия. Анатомия парастернальных лимфоузлов вариабельна, поэтому 2D планирование считается неэффективным. Нет гарантии, что все парастернальные лимфоузлы полностью покрывались предписанной дозой. Практически во всех исследованиях допускалось подведение 80-85% от предписанной дозы вместо классических 95%. Учитывая вариации в дозах (от 45 Гр за 18 фракций 4 дня в неделю из французского исследования до более стандартных 50 Гр за 25 фракций из EORTC и МА20), можно предположить, что доза на парастернальной зоне могла быть гораздо ниже представляемой, тем более что ее покрытие могло быть весьма вариабельно при разной толщине грудной стенки, особенно в условиях несовершенного 2D планирования. Так, исследование 2004 года по лимфосцинтиграфии парастернальных лимфоузлов с изучением степени их покрытия при облучении тангенциальными полями показало, что при толщине престернальной клетчатки ≤10 мм они как минимум частично покрыты в 100% случаев, тогда как при толщине >10 мм частичное покрытие отмечено лишь в 60% случаев [11].
Если предположить, что выигрыш в отдаленных показателях был достигнут даже при подведении неполных доз на парастернальные лимфоузлы, возможно, им и не надо много? Каждый радиотерапевт и медицинский физик представляет себе, что и обычные тангенты на грудную клетку или молочную железу частично покрывают парастернальную зону. Бразильские авторы в 2016 году провели оценку средних «случайных» доз на внутренних грудных лимфоузлах при 2D и 3D планировании облучения после мастэктомии без добавления отдельного парастернального поля и выяснили, что при 2D планировании случайная доза составляет 7,93 Гр, а при 3D – 20,64 Гр [12]. Многие практикующие специалисты называли и большие дозы в этой зоне, вплоть до 30-36 Гр, хотя до сих пор неизвестно, играет ли величина дозы какую-либо роль для парастернальных лимфоузлов. Возможно, есть что-то, что мы пока не знаем о них. Возможно, их природа, их биология отличаются от биологии лимфоузлов других зон совершенно иной, более индолентной способностью – не накапливать и взращивать метастазы и отправлять их в свободное плавание, но кумулировать метастатические клетки и оставлять их при себе. В любом случае, по данным исследования EORTC 22922 риск рецидива в парастернальной зоне был крайне низок – 0,8% даже без облучения, а по данным крупного исследования Chen et al. 2010 года с включением почти 9 тысяч пациенток, рецидивы с поражением внутренних грудных лимфоузлов отмечены в 1,5% случаев, а рецидивы в них в качестве 1 очага были почти казуистичны – 0,5%, и прогноз у этой группы больных при отсутствии других очагов метастазирования был хорошим [13].
Упорные попытки подвести стандартные послеоперационные дозы к парастернальной зоне могут быть более проблемными в случае нестандартной анатомии грудной клетки или при ее изменении после одномоментной реконструкции с постановкой имплантатов или экспандера, а частота подобных операций значительно возросла в настоящее время. Изменение геометрии грудной клетки чревато неадекватностью покрытия отдельных участков грудной стенки при применении стандартных методик (и, следовательно, повышению риска локального рецидива) либо увеличением доз на критических органах (легких, сердце при левосторонней локализации) [14]. Не стоит полагать, что в нынешний век продвинутых технологий эта проблема полностью ушла. В России, где по-прежнему остро стоит необходимость глубокого теоретического и практического обучения радиотерапевтов и медицинских физиков, а также проблема отсутствия качественного обучения работе на современном оборудовании, частота неадекватности планов лучевой терапии может быть высокой – просто эта тема у нас не изучалась.
Авторы исследования EORTC 22922 до сих пор продолжают анализировать полученные результаты, уже спустя 15 лет после завершения набора больных. В 2020 году в журнале Lancet Oncology были опубликованы данные по отдаленным непосредственным результатам за 15 лет [15], а буквально недавно – в конце июля 2021 года – в Journal of Natural Cancer Institute были проанализированы данные, касающихся поздних лучевых осложнений [16]. В отношении общей выживаемости за 15 лет тенденция была полностью сохранена: разница составила всего 2,2%, не достигнув статистической достоверности (73,1% при облучении лимфоузлов против 70,9% без него, р=0,36). Весомых различий в ВБП и выживаемости без отдаленных метастазов также не отмечено. Расширение объемов облучения позитивно сказалось лишь на снижении риска локорегиональных рецидивов (24,5% против 27,1%, р=0,024) и смертности от рака молочной железы (16,0% против 19,8%, р=0,005), хотя, опять-таки, разница была невелика. Но если преимущество облучения парастернальной зоны все же сомнительно, то потенциальный риск осложнений от этого вполне реален. Кумулятивная частота легочных фиброзов за 15 лет оказалась достоверно вдвое выше при добавлении полей на лимфоузлы: 5,7% против 2,9% (P<0,001), кардиальный фиброз также регистрировался чаще (1,9% против 1,1%, P=0,07), так же как и любая сердечная патология (11,1% против 9,4%, P=0,04), хотя в целом радует, что общая частота подобных осложнений была невелика, даже при проведении преимущественно конвенционального облучения (рис.2). Но, скорее всего, учитывая все вышеизложенные факты, включение парастернальной зоны в объем облучения не требуется абсолютно всем пациентам – оно должно быть избирательным.
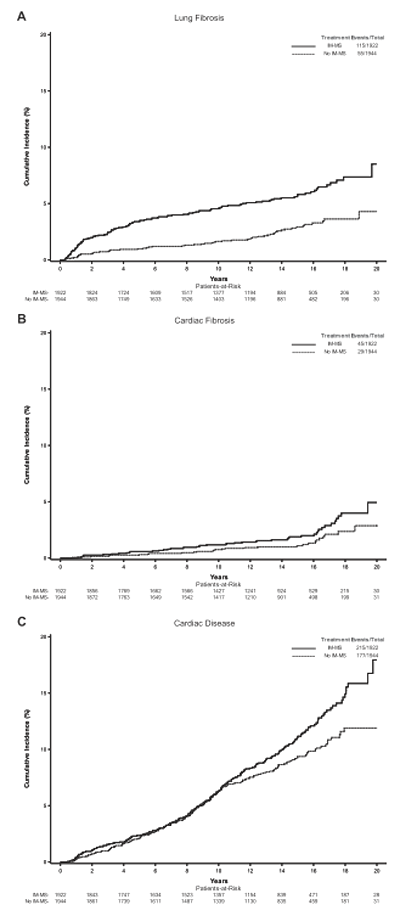
Рисунок 2. Частота легочных (А) и кардиальных (В) фиброзов и сердечной патологии (С)
за 15 лет после облучения региональных зон или без него (данные EORTC 22922 [16]).
Кому стоит отдать предпочтение в плане облучения парастернальных лимфоузлов?
Вероятнее всего, не нужно брать за основу только размеры первичной опухоли и массивность поражения лимфоузлов, скорее, наоборот. Первый главный момент – локализация опухоли. Есть уже давнее мнение, что опухоли латеральных и медиальных локализаций ведут себя по-разному. В исследовании из Института Густава Русси, включающем почти 1200 больных, лечебные манипуляции в парастернальной зоне (лучевая терапия и/или операция) достоверно снижали риск отдаленного метастазирования в 1,6 раза ТОЛЬКО у больных с медиальной локализацией опухоли в сочетании с N+ [17]. И исследование EORTC 22922, и датское DBCG-IMN тоже продемонстрировали выигрыш парастернального облучения при медиальных локализациях в сравнении с латеральными в отношении снижения риска смерти (EORTC: HR 0,84 против 0,93) и улучшении ОВ (DBCG-IMN: HR 0,80 при медиальной/центральной опухоли в сочетании с N+ против HR 1,13 при латеральной локализации с 1-3 вовлеченными лимфоузлами). Во французском исследовании наибольшая разница в результатах 10-летней общей выживаемости (преимущество в 7-7,5%) была достигнута при облучении парастернальной зоны больным с медиальной/центральной локализацией опухоли и пораженными подмышечными лимфоузлами, независимо от того, получали они ХТ или нет, хотя статистическая достоверность достигнута не была.
Предпочтение стоит отдать пациенткам с рецептор-негативными опухолями и особенно с трижды негативным раком молочной железы с учетом колоссального риска рецидива именно в области региональных зон (по данным Voduc KD et al. 2010 [18] этот риск практически в 4 раза выше для трижды негативного подтипа в сравнении с люминальным А подтипом, а по данным канадского МА20 достоверное улучшение ОВ было отмечено именно для группы пациенток ЭР/ПР-).
Размышлять на эту тему можно долго – но снять основную массу вопросов могли бы лишь проспективные исследования с унифицированной методикой планирования и облучения парастернальной зоны и с применением современных технологий.
Источники: