07.10.2021

Современная иммунотерапия, безусловно, совершила революцию в лечении пациентов с меланомой кожи. Достигнуты высокие результаты выживаемости пациентов с распространенными стадиями заболевания. В настоящее время мы становимся свидетелями возможного применения ингибиторов контрольных точек иммунного ответа на более ранних стадиях, в адъювантном, а также неоадъювантном режимах.
Одним из значимых событий Конгресса ESMO 2021 года стало выступление Jason Luke на Президентском симпозиуме с результатами первого промежуточного анализа исследования KEYNOTE-716, свидетельствующими, что назначение пембролизумаба в адъювантном режиме увеличивает безрецидивную выживаемость при меланоме кожи II стадии высокого риска [1].
Рисунок 1. Докладчики на Президентском симпозиуме 1. Дискуссионная сессия: Меланома и другие опухоли кожи (Конгресс ESMO 2021).
Современным стандартом ведения пациентов с меланомой кожи II стадии после радикального удаления является наблюдение. Адъювантная таргетная или анти-PD1 терапия назначается начиная с IIIA стадии. Пациенты с меланомой IIB и IIC стадии имеют глубокую или изъязвленную первичную опухоль (T3b, T4a, T4b) и имеют такой же риск рецидива заболевания и смерти, как и пациенты с меланомой стадии IIIA и IIIB. Представленные промежуточные результаты исследования KEYNOTE-716 могут изменить текущий подход, поскольку показывают, что адъювантная иммунотерапия должна быть новым стандартом лечения меланомы II стадии высокого риска.
В рандомизированное двойное слепое исследование III фазы включено 976 пациентов старше 12 лет со II стадией меланомы кожи и высоким риском прогрессирования заболевания (IIb и IIc стадии) после радикального удаления первичной опухоли. Пациенты рандомизированы либо в группу пембролизумаба 200 мг (2 мг/кг для детей) в/в капельно 1 раз в 3 недели (всего 17 циклов), либо в группу плацебо. Длительность лечения – до 1 года.
Стратификация у взрослых пациентов проведена по категории T (3b, 4a, 4b) и по отдельной страте для педиатрических пациентов. Большинство пациентов (64%) имели IIB стадию заболевания, почти в два раза реже наблюдалась IIC стадия (34,8%).
Первичная конечная точка исследования – безрецидивная выживаемость по оценке исследователей. Первый промежуточный анализ показал, что применение пембролизумаба в адъювантном режиме снижает риск рецидива заболевания на 35% по сравнению с плацебо (отношение риска 0,65; 95% доверительный интервал 0,46-0,92; p=0,00658) при медиане наблюдения 14,4 месяца. Медиана продолжительности жизни без прогрессирования не достигнута ни в одной группе. Применение пембролизумаба привело к снижению частоты рецидивов по сравнению с плацебо (11,1% против 16,8%) и уменьшению почти в два раза частоты появления отдаленных метастазов (28 против 38). Безрецидивная выживаемость за 12 месяцев составила 90,5% в группе иммунотерапии и 83,1% в группе плацебо (рис.2).
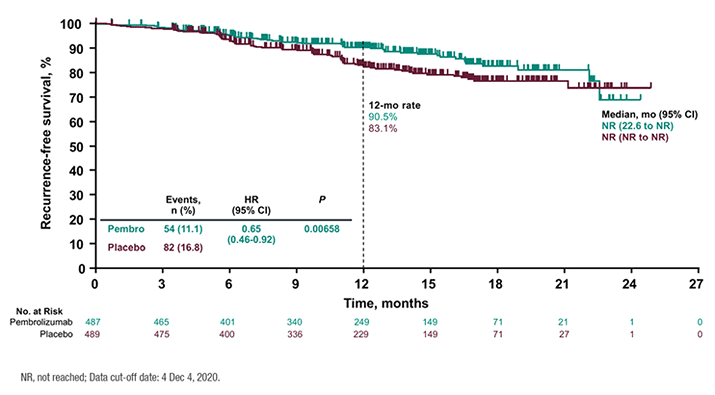
Рисунок 2. Риск безрецидивной выживаемости по оценке исследователей значительно ниже в группе адъювантного пембролизумаба по сравнению с группой плацебо (LBA3, ESMO 2021).
Частота любых нежелательных явлений ≥3 степени была выше при применении пембролизумаба по сравнению с плацебо (25,9% против 17,1%), а частота нежелательных явлений ≥3 степени, связанных с лекарственными препаратами, была выше в группе пембролизумаба по сравнению с плацебо (16,1% против 4,3%). Ввиду нежелательных явлений лечение прекращено у 15,3% пациентов в группе пембролизумаба по сравнению с 2,5% пациентов с плацебо.
В группе пембролизумаба не было случаев смерти, а в группе плацебо четыре пациента умерли ввиду нежелательных явлений. Иммуноопосредованные нежелательные явления зарегистрированы у 36,2% пациентов, получавших пембролизумаб, и у 8,4% пациентов, получавших плацебо. Наиболее частыми иммуноопосредованными нежелательными явлениями были гипотиреоз (15,7% в группе пембролизумаба против 3,5% в группе плацебо) и гипертиреоз (10,4% в группе пембролизумаба против 0,6% в группе плацебо); большинство иммуноопосредованных нежелательных явлений были 1-2 степени тяжести.
Таким образом, пациенты, радикально прооперированные по поводу меланомы кожи IIB и IIC стадии, имеют высокий риск рецидива. Исследование KEYNOTE-716 является первым рандомизированным, двойным слепым исследованием III фазы, которое показало, что анти-PD-1- терапия пембролизумабом в адъювантном режиме значительно снижает риск рецидива по сравнению с плацебо при меланоме кожи II стадии высокого риска.
Reinhard Dummer представил 5-летние результаты рандомизированного исследования III фазы COLUMBUS по сравнению эффективности комбинации энкорафениб + биниметиниб против энкорафениба или вемурафениба у пациентов с метастатической BRAF V600-мутированной меланомой [2]. Энкорафениб и биниметиниб не зарегистрированы в России. В первую часть исследования включено 577 пациентов, не получавших ранее лечения или с прогрессированием опухоли после иммунотерапии первой линии. Рандомизация проводилась в соотношении 1:1:1: энкорафениб 450 мг один раз в день + биниметиниб 45 мг два раза в день; энкорафениб 300 мг один раз в день или вемурафениб 960 мг два раза в день.
Обновленный анализ проведен после минимального наблюдения за пациентами в течение 65 месяцев. В группе энкорафениб + биниметиниб показатели 5-летней ОВ (95% ДИ) у всех пациентов (n=192), с уровнем лактатдегидрогеназы (ЛДГ) ≤ верхней границы нормы на исходном уровне (n=137) и низкой опухолевой нагрузкой (n=88) составила 35% (28-42), 45% (36-53) и 48% (37-58) соответственно. Результаты исследования представлены в таблице 1.
Таблица 1. 5-летние результаты исследования III фазы COLUMBUS по сравнению эффективности: энкорафениб + биниметиниб против энкорафениба или вемурафениба у пациентов с метастатической меланомой при наличии мутации в гене BRAF V600.
Данные по безопасности соответствовали известному профилю переносимости комбинации энкорафениб + биниметиниб. Побочными явлениями, встречающимися у ≥20% пациентов на комбинированной терапии энкорафениб + биниметиниб, были тошнота, диарея, рвота, артралгия, усталость, повышение креатинфосфокиназы крови (КФК), головные боли, запоры, астения и пирексия. Токсичность 3/4 степени наблюдалась у ≥2,5% пациентов, это были гипертония, пирексия, боли в животе, диарея и рвота. Изменения лабораторных показателей 3/4 степени отмечены у ≥2,5% пациентов, включали повышенный уровень гамма-глутамилтрансферазы, КФК, аланин-трансаминазы и гипергликемию. Виду побочных эффектов в каждой рандомизированной группе прекратили лечение 12-14% пациентов. Наиболее часто назначаемыми противоопухолевыми препаратами после таргетной терапии были ингибиторы контрольных точек иммунного ответа.
Обновленные результаты исследования подтвердили длительно сохраняющуюся эффективность комбинированной терапии энкорафениб + биниметиниб у пациентов с метастатической меланомой BRAF V600.
Ввиду недостаточно высокой эффективности современной иммунотерапии постоянно идет поиск новых путей противодействия опухолевой экспансии, и в дополнение к уже известным ингибиторам контрольных точек иммунного ответа выявляются новые перспективные мишени воздействия, в частности, ингибиторы LAG-3. LAG3 – это рецептор иммунного чек-пойнта, обладающий многочисленными биологическими эффектами на функции T-лимфоцитов, включая связывание молекул главного комплекса гистосовместимости со значительным подавлением активности иммунной системы.
В клиническом исследовании RELATIVITY-047 оценивалась эффективность комбинации релатлимаб (RELA), LAG-3 антитела + ниволумаб (NIVO) в сравнении с монотерапией ниволумабом у не леченых ранее пациентов с метастатической меланомой. Результаты терапии указанной комбинацией продемонстрировали высокие показатели выживаемости без прогрессирования (ВБП), хорошую переносимость и безопасность [3].
Семьсот четырнадцать пациентов были рандомизированы в группы RELA + NIVO (n=355) или NIVO (n=359). Доза ниволумаба была фиксированной: 480 мг в/в каждые 4 недели. Лечение продолжалось до прогрессирования, неприемлемой токсичности или отзыва согласия. ВБП оценивалась по подгруппам. ВБП 2 определялась как время от рандомизации до прогрессирования процесса при последующей терапии или смерти. Также оценивалось свободное от лечения время: от последней исследуемой дозы до последующей терапии.
Терапия комбинацией RELA + NIVO увеличила ВБП в определенных подгруппах, включая BRAF, M стадию по AJCC v.8 и ЛДГ. Медиана продолжительности лечения составила 5,6 месяца для RELA + NIVO и 4,9 месяца для NIVO. Лечение было прекращено, в основном из-за прогрессирования заболевания, в 36,3% и 46,0% случаях соответственно.
Пациенты, получавшие последующую системную терапию в группе RELA + NIVO и группе NIVO, составили 27,9% и 29,8% соответственно, включая ингибиторы PD-1 или CTLA-4 (9,0% против 12,8%) и терапию BRAF/MEK (11,5% против 13,9%).
Медиана ВБП 2 в группе RELA + NIVO не достигнута (95% ДИ 21,8-NA), в группе NIVO составила 20,0 месяцев (95% ДИ 15,4-25,1), отношение рисков [HR] 0,77 (95% ДИ 0,61–0,97) (рис.3). Медиана времени без лечения от последней дозы исследования до последующей терапии составила 3,98 месяца (95% ДИ 2,10-7,43) для RELA + NIVO против 1,45 месяца (95% ДИ 1,25-1,71) для NIVO (ОР 0,63; 95% ДИ 0,48-0,83).
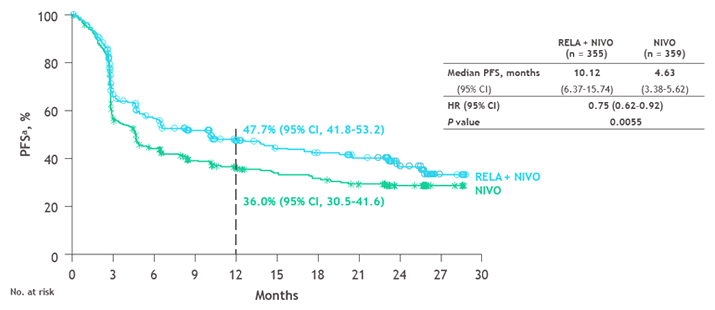
Рисунок 3. Исследование RELATIVITY-047: преимущество ВБП при комбинации Relatlimab + Nivolumab против монотерапии Nivolumab.
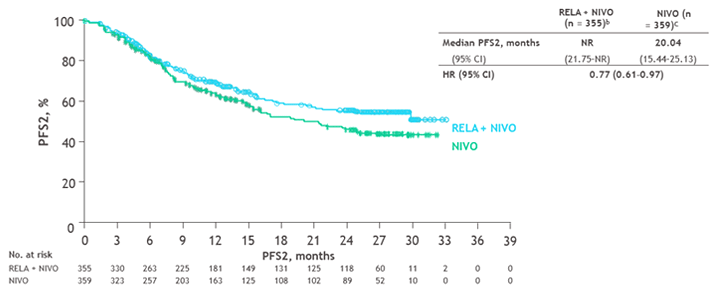
Рисунок 4. Исследование RELATIVITY-047: преимущество ВБП 2 при комбинации Relatlimab + Nivolumab против монотерапии Nivolumab.
Выводы: Применение комбинации RELA + NIVO у пациентов с метастатической меланомой в первой линии терапии продемонстрировало длительную ВБП, а также преимущество после первого прогрессирования, включая более длительное время до начала последующего лечения по сравнению с монотерапией NIVO.
Paolo Ascierto представил данные рандомизированного исследования II фазы SECOMBIT по выбору наилучшей последовательности в первой линии терапии у пациентов с метастатической меланомой с наличием мутации в гене BRAF: комбинированная иммунотерапия ипилимумабом (IPI) и ниволумабом (NIVO) или комбинированная таргетная терапия энкорафенибом (E) и биниметинибом (B) [4].
Лечение таргетной терапией (ингибиторы BRAF и MEK) и ингибиторами иммунных контрольных точек (анти-CTLA4, анти-PD-1) улучшило результаты лечения пациентов с метастатической меланомой BRAF-V600 в первой линии. Таргетная терапия продемонстрировала более высокие показатели ответа, но длительность ответа была ограничена, в то время как комбинация иммунотерапии IPI + NIVO характеризуется более низкой частотой ответа, но более продолжительным ответом. Вопрос о наилучшей последовательности остается открытым. Кроме того, короткий курс таргетной терапии, переключенный на иммунотерапию IPI + NIVO, поддерживается доклиническими исследованиями и может быть клинически целесообразен. С целью изучения наилучшей последовательной стратегии начато исследование SECOMBIT – рандомизированное исследование II фазы с тремя рукавами (NCT02631447).
С ноября 2016 года по май 2019 года в 37 центрах из 9 стран в исследование были включены пациенты (n=251) с не леченой ранее метастатической меланомой и наличием мутации в гене BRAF V600. Пациенты были рандомизированы в одну из трех групп: в группу A (E+ B до прогрессирования, затем IPI + NIVO до прогрессирования), в группу B (IPI + NIVO до прогрессирования, затем E+ B до прогрессирования) или в группу C (E+ B в течение 8 недель, затем IPI + NIVO до прогрессирования, затем E+ B до прогрессирования).
Схемы лечения были следующими: таргетная терапия – E 450 мг в день + B 45 мг в день; иммунотерапия – IPI 3 мг/кг + NIVO 1 мг/кг каждые 3 недели, 4 цикла, затем N 3 мг/кг каждые 2 недели. ОВ является основной конечной точкой исследования. Вторичные конечные точки включали общую ВБП, 2- и 3-летнюю выживаемость, общую частоту ответов, продолжительность ответа, оценку уровня биомаркеров.
Медиана наблюдения составила 32,2 месяца (диапазон 27,9-41,6 мес.). Медиана ОВ не достигнута ни в одной из групп лечения. Показатели 2-летней и 3-летней ОВ составили 65% и 54% в группе А, 73% и 62% в группе В, 69% и 60% в группе С соответственно. ВБП через 2 и 3 года равнялась 46% и 41% в группе A, 65% и 53% в группе B, 57% и 54% в группе C соответственно (рис.5.).
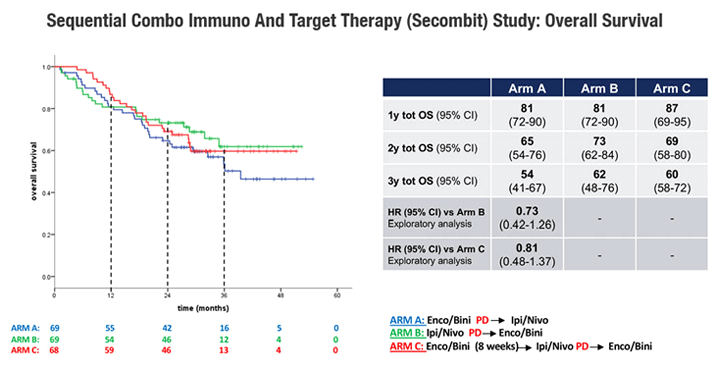
Рисунок 5. Тенденция к более благоприятной выживаемости в течение 2 и 3 лет для групп B и C по сравнению с группой A (Abstract LBA40, ESMO 2021).
Таким образом, показатели OВ и ВБП через 2 и 3 года продемонстрировали лучшую тенденцию в группах B и C. Продолжается сбор данных для предоставления дополнительной информации о долгосрочной пользе трех комбинаций лечения. Анализ биомаркеров продолжается.
Заслуживают внимание представленные JS Weber результаты исследования II фазы по эффективности комбинации ипилимумаба, ниволумаба и тоцилизумаба для неоперабельной метастатической меланомы [5].
Комбинированная иммунотерапия ипилимумаба с ниволумабом имеет частоту ответов 45-55%, при этом 50% пациентов имеют побочные эффекты 3-5 степени. Высокий уровень сывороточного IL-6 коррелирует с низкой эффективностью ингибиторов контрольных точек иммунного ответа и короткой выживаемостью при многих злокачественных опухолях. Тоцилизумаб – это гуманизированное антитело, блокирующее рецептор IL-6, одобренное для лечения ревматоидных артритов и синдрома высвобождения цитокинов. Являясь иммунодепрессантом, тоцилизумаб купирует иммуноопосредованные нежелательные явления, в том числе резистентные к стероидам.
Исследование было проведено для оценки, может ли тоцилизумаб снизить токсичность и/или повысить эффективность ингибиторов контрольных точек иммунного ответа. Пациентам с метастатической меланомой проводилась иммунотерапия: ипилимумаб в дозе 1 мг/кг и ниволумаб в дозе 3 мг/кг вводили внутривенно каждые 3 недели, 4 раза во время индукции, затем поддержка ниволумабом в течение 2 лет. Тоцилизумаб вводили по 4 мг/кг каждые 6 недель внутривенно в течение первых 24 недель.
В исследование включено 28 пациентов, 14 мужчин и 14 женщин, средний возраст составил 67 лет, ECOG статус пациентов был 0-1. Большинство (24) больных имели IV стадию заболевания и только четверо – IIIC/D стадию. Наблюдалось 5 случаев иммуноопосредованных нежелательных явлений 3-4 степени (энтерит, колит, нефрит, два случая повышения уровня трасаминаз). Медиана наблюдения составила 6 месяцев. Частота объективных ответов равнялась 70% (14 из 20), у двух пациентов сохранялась стабилизация процесса в течение 18 недель. Четыре пациента имели прогрессирование и двое умерли.
Высокий уровень TNF-альфа коррелировал с 3-4 степенью токсичности, а повышенный уровень IL-6/IL-8 – с прогрессированием опухолевого процесса.
Таким образом, измененный режим комбинированной терапии IPI/NIVO (ипилимумаб 1 мг/кг и ниволумаб 3 мг/кг) с тоцилизумабом обладает многообещающей противоопухолевой активностью с благоприятным профилем токсичности. В дальнейшем будут представлены результаты корреляционных исследований.
На ESMO 2021 продемонстрированы 3-летние результаты лечения пациентов с метастазами меланомы в головной мозг комбинацией ниволумаба (NIVO) и ипилимумаба (IPI) (исследование II фазы CheckMate 204 [6]).
В исследовании показано, что наилучшие результаты лечения меланомы с метастатическим поражением головного мозга комбинацией NIVO + IPI наблюдались у бессимптомных пациентов (когорта А) по сравнению с теми пациентами, которые имели симптомы поражения ЦНС (когорта В). Оценка данных проводилась как исследователями (INV), так и с помощью слепой независимой центральной экспертизы (BICR).
В многоцентровом исследовании пациенты с метастатической меланомой в головной мозг получали комбинацию NIVO 1 мг/кг + IPI 3 мг/кг каждые 3 недели ×4, затем NIVO 3 мг/кг каждые 2 недели до прогрессирования или неприемлемой токсичности. Первичной конечной точкой был показатель клинической эффективности IC, определяемый как доля пациентов с полным ответом (CR), частичным ответом (PR) или стабильным заболеванием (SD) ≥6 месяцев (RECIST 1.1).
При медиане наблюдения 34 месяца в когорте А и 7,5 месяца в когорте В оценен 101 пациент с бессимптомным течением и 18 пациентов с наличием симптомов поражения ЦНС. Показатели INV- и BICR-ответов были согласованными (табл.2), при этом коэффициент соответствия между оцениваемыми показателями составлял 85% для когорты A и 94% для когорты B. Общий ответ на лечение был значительно выше в когорте пациентов без симптомов поражения ЦНС. ВБП на период 36 месяцев для когорты A составила 54% (95% ДИ 43-64) по INV и 52% (41-62) по BICR, а показатель ОВ составил 72% (62-80). Для когорты В 36-месячный показатель ВБП равнялся 19% (95% ДИ 5-40) по INV и 28% (10-50) по BICR, а ОВ – 37% (14-60). Никаких новых нежелательных явлений или смертей, связанных с лечением, не наблюдалось.
Таблица 2. Эффективность лечения пациентов с метастазами меланомы в головной мозг комбинацией ниволумаба (NIVO) и ипилимумаба (IPI) (исследование II фазы CheckMate 204).

a В общее количество пациентов включены 6 бессимптомных и 1 пациент с симптомами, для которых независимая оценка недоступна.
CI – доверительный интервал; ORR – объективная частота ответов.
Выводы: отмечена высокая согласованность между ответами INV и BICR для обеих когорт. Высокие 3-летние показатели ОВ и ВБП для бессимптомной когорты поддерживают использование комбинации NIVO + IPI у пациентов с метастазами меланомы в головной мозг в качестве первой линии. Пациенты с наличием симптомов поражения головного мозга по-прежнему трудно поддаются лечению, лишь у некоторых из них могут наблюдаться длительные ответы на комбинированной терапии NIVO + IPI.
В рамках сессии «Меланома и другие опухоли кожи» Helen Gogas с коллегами обсудили результаты исследования фазы III MASTERKEY-265 по иммунотерапии Talimogene laherparepvec (T-VEC) в сочетании с пембролизумабом у пациентов с прогрессирующей меланомой. T-VEC – аттенуированный вирус простого герпеса человека 1 типа (не зарегистрирован в России). Комбинированная терапия не позволила достичь первичной конечной точки выживаемости без прогрессирования (ВБП), несмотря на более ранние многообещающие результаты фазы Ib [7].
В исследование MASTERKEY-265 были включены 692 пациента с неоперабельной/метастатической (стадия IIIB-IVM1C) меланомой. Пациенты не получали анти-PD-1 терапию. При медиане наблюдения 31,0 месяц отношение рисков (HR) для ВБП – первичной конечной точки наряду с общей выживаемостью (ОВ) – составило 0,86 (95% доверительный интервал [ДИ] 0,71-1,04; р=0,13), при этом медиана ВБП составила 14,3 месяца для T-VEC + пембролизумаб и 8,5 месяца для плацебо + пембролизумаб (рис.6). Данные по ОВ не являются зрелыми, в промежуточном анализе не сообщалось о преимуществе выживаемости (медиана еще не достигнута при T-VEC + пембролизумаб по сравнению с 49,2 месяца с плацебо + пембролизумаб; ОР 0,96; 95% ДИ 0,76-1,22; р=0,74). Существенных улучшений показателей при первичном анализе не ожидается.
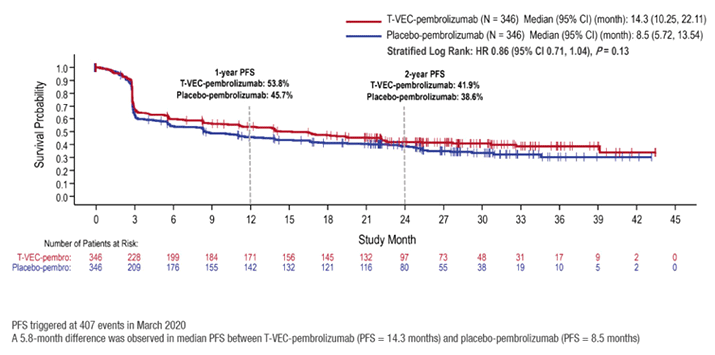
Рисунок 6. Исследование MASTERKEY-265: первичная конечная точка – ВБП не соответствует статистической значимости при медиане наблюдения 31 месяц.
По мнению доктора Marco Donia, которое он высказал в дискуссии, разочаровал тот факт, что обнадеживающие результаты ранних клинических исследований не привели к улучшению выживаемости в более крупном исследовании III фазы. Аналогичная история наблюдалась с комбинацией эпакадостат + пембролизумаб в исследовании ECHO-301 /KEYNOTE-252 (Lancet Oncol. 2019; 20 (8): 1083-1097), при этом не было показано преимуществ выживания по сравнению с плацебо + пембролизумаб. Возможно, будущий анализ или исследование, сосредоточенные на подгруппах пациентов с конкретными биомаркерами, могут оказаться более информативными в выявлении пациентов, которые с большей вероятностью выиграют от комбинации.
Несмотря на отрицательные результаты в комбинации с пембролизумабом, T-VEC продолжает играть важную роль в лечении пациентов с меланомой, и новые исследовательские подходы к иммунотерапии с помощью T-VEC продемонстрировали обнадеживающие ранние результаты. Например, было представлено клиническое испытание I фазы внутриопухолевой инъекции аутологичных CD1c (BDCA-1)+/CD141 (BDCA-3) + миелоидных дендритных клеток (MYDC) в сочетании с T-VEC у пациентов с прогрессирующей меланомой (резюме 962MO).
Хотя в исследование было включено только 13 пациентов, сообщалось о противоопухолевой активности – у 2 пациентов была достигнута патологическая полная ремиссия, у 1 пациента был частичный ответ, а у 2 пациентов был смешанный ответ – с регрессией, происходящей как в местах инъекции, так и в других очагах.
Marco Donia отметил, что многие потенциальные агенты находятся в разработке, и на данный момент лидером, по-видимому, является онколитическая вирусная терапия, такая как T-VEC, но необходимо определить любые клинические различия между этими методами лечения.
В заключении следует отметить, что, несмотря на достигнутые результаты, изменившие стандарты лечения пациентов с меланомой кожи, и непростую эпидемиологическую обстановку, клинические исследования продолжаются. Нерешенных вопросов достаточно. Множество работ посвящены поиску предикторов ответа на противоопухолевую терапию, изучению новых комбинаций, преодолению резистентности, анализу нежелательных явлений. Обсуждение новых данных, применение их в практической онкологии, позволяет повысить эффективность лечения и продлить жизнь нашим пациентам.
Источники: