04.10.2021

Паллиативная лучевая терапия после стентирования у больных распространенным раком пищевода
Продолжительность жизни больных с распространенным раком пищевода очень невелика – 6-8 месяцев, и у подавляющего большинства пациентов имеется дисфагия вплоть до полной непроходимости пищи. Постановка саморасправляющегося стента – типичное паллиативное вмешательство для таких больных, однако дальнейший рост опухоли продолжает ухудшать проявления дисфагии. Исследователи из нескольких центров Великобритании постарались определить, насколько эффективно паллиативное облучение в плане сдерживания нарастающей дисфагии у больных с установленным стентом [1]. В проспективное рандомизированное исследование 3 фазы было включено 220 некурабельных больных раком пищевода со стентом, для ITT анализа – 199 из них (102 – в группе наблюдения после постановки стента, 97 – в группе ЛТ). Облучение проводилось в 2 режимах: 20 Гр за 5 фракций или 30 Гр за 10 фракций. Первичной конечной точкой было выбрано усугубление дисфагии более чем на 11 пунктов по опроснику QLQ-OG25 или смертность за 12 недель. Увы, паллиативная лучевая терапия не повлияла на дальнейшее усугубление дисфагии: оно отмечено у 36 (49%) пациентов группы поддерживающего лечения и у 34 (45%) из группы ЛТ (OR 0,82; 95% CI 0,40-1,68; p=0,59). Не было разницы и в показателях выживаемости: медиана ОВ составила 19,7 недель в группе поддерживающего лечения против 18,9 недель в группе облучения (р=0,70). Однако средний промежуток времени до кровотечения или госпитализации в связи с кровотечением оказался больше у облученных пациентов: 65,9 недель против 49,0 недель (р=0,038). Наиболее частым осложнением 3-4 степени оказалась слабость, встречавшаяся чаще после облучения (23% против 19%). В целом авторы сделали вывод, что проведение лучевой терапии в этой сложной категории больных с инкурабельным раком пищевода после стентирования нецелесообразно, за исключением, возможно, только тех, у кого имеется повышенный риск кровотечения из опухоли.
Дурвалумаб в комбинации с SBRT в качестве неоадъюванта при раннем НМРЛ
Ряд исследований 2 фазы по применению анти-PD-1 и анти-PD-L1 иммунопрепаратов в качестве монотерапии в неоадъюванте при раннем НМРЛ продемонстрировали частоту близких к полным патоморфологических ответов в диапазоне 15-45%. Американские исследователи из одного из центров Нью-Йорка предположили, что добавление SBRT позволит увеличить частоту ответов за счет активации противоопухолевого иммунного ответа [2]. В исследование 2 фазы было включено 60 пациентов с ранним НМРЛ I-IIIA стадий, которые на неоадъювантном этапе получали либо только дурвалумаб в монорежиме (30 больных), либо комбинацию дурвалумаба с SBRT на первичную опухоль (30 больных). Препарат вводился дважды 1 раз в 3 недели, в группе ЛТ – сразу после облучения в дозе 24 Гр за 3 фракции. Пациенты без системного прогрессирования шли на оперативное лечение. Первичной конечной точкой являлся патоморфологический ответ в первичной опухоли, близкий к полному.
В каждой группе по 26 (87%) больных было прооперировано. При этом почти полный ответ был достигнут у 2 больных из группы монотерапии (6,7%) и у 16 (53,3%) – из группы комбинации, из них у половины – полный патоморфологический регресс. При этом толерантность лечения была вполне удовлетворительной, обошлось без токсичности 5 степени, хотя избежать клинически выраженных осложнений не удалось (частота их была примерно одинакова – 17% в группе монотерапии и 20% в группе комбинации). Авторы пришли к мнению, что подобный неоадъювантный подход имеет право на существование, необходимо продолжать исследование. Тем не менее, сомнения в его целесообразности остаются. Учитывая появление новых данных о высокой эффективности SBRT у больных ранним НМРЛ в сравнении с хирургическим лечением (Chang JY et al, Lancet Oncol 2021), не рациональнее ли глубже изучить эффективность консервативного подхода (SBRT с иммунотерапией), чем вновь возвращаться к проблеме трехмодального лечения раннего НМРЛ с весьма сомнительными преимуществами?
НМРЛ: ХЛТ и дурвалумаб у пациентов с мутацией KEAP1-NFE2L2
Консолидирующая иммунотерапия после радикального химиолучевого лечения нерезектабельного НМРЛ III стадии стала стандартом, позволив значительно улучшить показатели ВБП и ОВ, это продемонстрировали результаты исследования PACIFIC в 2017 году, и на протяжении 5 лет тенденция сохраняется. Дополнительные анализы исследования показали, что от иммунотерапии дурвалумабом выигрывали различные подгруппы пациентов, в том числе и те, кто изначально имел низкую экспрессию PD-L1 (менее 1%) – это одно из проявлений синергизма лучевой/химиолучевой терапии и иммунотерапии. Еще одно достижение подобной комбинации продемонстрировали американские исследователи из Memorial Sloan Kettering Cancer Center [3].
Известно, что примерно четверть больных НМРЛ имеют мутации генов KEAP1-NFE2L2, и ранее было показано, что они являются причиной высокой радиорезистентности опухолей и ранних локорегионарных рецидивов более чем у половины пациентов, прошедших ХЛТ. Shaverdian et al. в ретроспективном исследовании поставили задачу оценить, насколько эффективен дурвалумаб в этой когорте больных и способен ли он нивелировать различия в частоте локорегионарных рецидивов.
Сто двадцать больных местнораспространенным НМРЛ III стадии были распределены в группы только одновременной ХЛТ (54 пациента) и ХЛТ с последующей иммунотерапией (66 больных). Частота локорегионарных рецидивов за 12 месяцев оказалась более чем в 2 раза ниже с дурвалумабом (18% против 39%, p=0,002), как и ожидалось (рис.1). KEAP1-NFE2L2-мутация явилась предиктором ЛРР (HR 3,9; 95% CI 1,6-9,8; p=0,003), но при этом добавление дурвалумаба действительно ликвидировало различия в частоте ЛРР между мутантными и немутантными опухолями (p=0,541), и мутация KEAP1-NFE2L2 переставала быть предиктивным фактором для этой сложной категории больных (рис.2,3). При этом у больных с выявленной мутацией дурвалумаб значительно снижал частоту ЛРР по сравнению с группой больных, получивших только ХЛТ: 25% рецидивов за 12 месяцев против 60% (p=0,021). Без сомнения, это еще одна победа в копилке консолидирующей иммунотерапии.
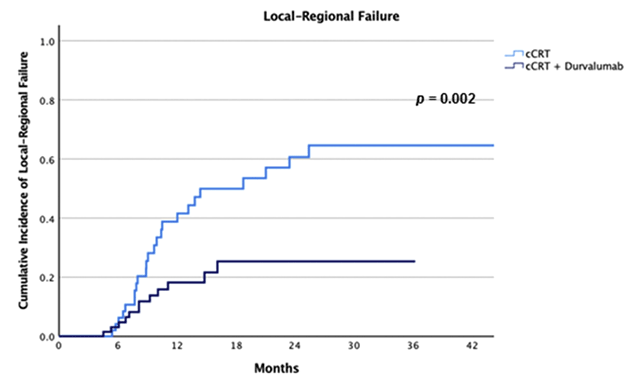
Рисунок 1. Частота ЛРР после ХЛТ и ХЛТ + дурвалумаб.
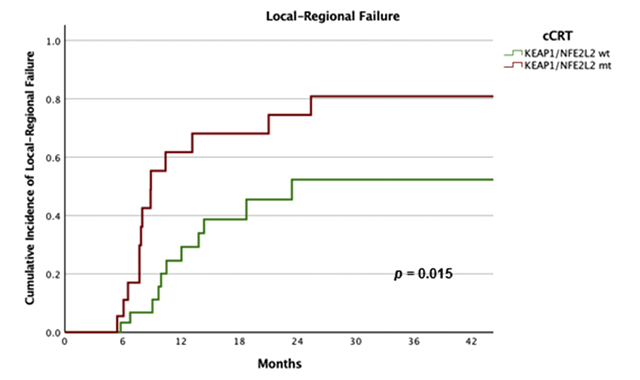
Рисунок 2. Частота ЛРР после ХЛТ у пациентов с KEAP1-NFE2L2 мутацией.
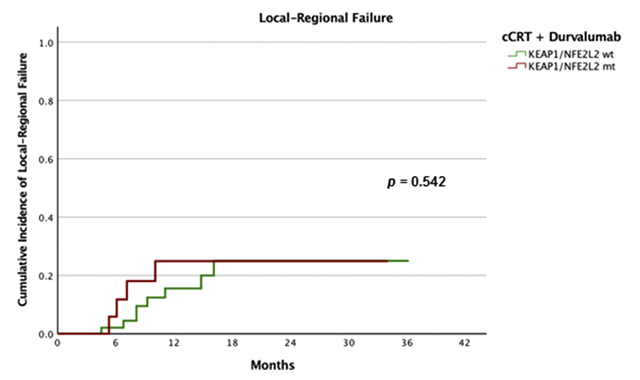
Рисунок 3. Частота ЛРР после ХЛТ+дурвалумаб у пациентов с KEAP1-NFE2L2 мутацией.
Неоадъювантная ХТ+ХЛТ при местнораспространенном раке прямой кишки
Подход TNT – тотального неоадъювантного лечения – при местнораспространенном раке прямой кишки набирает обороты. Результаты недавнего французского исследования UNICANCER-PRODIGE 23 [4] еще раз подтверждают это. Мультицентрическое рандомизированное исследование 3 фазы проводилось с 2012 по 2017 годы в 35 центрах Франции, общее число пациентов – 461 с cT3 или cT4 M0, рандомизированных на две группы: группа TNT (FOLFIRINOX до 6 курсов, затем ХЛТ (50 Гр на фоне капецитабина), операция и 3 курса адъювантной ХТ по схеме FOLFOX6) и группа стандартного лечения (ХЛТ, операция + 6 месяцев адъювантной ХТ). Первичная конечная точка – выживаемость без прогрессирования за 3 года, оцененная в популяции ITT. Средний период наблюдения составил 46,7 месяца, и показатели ВБП оказались достоверно лучше в группе TNT: 76% против 69% (HR 0,69; 95% CI 0,49-0,97; p=0,034). На неоадъювантном этапе частота и выраженность осложнений практически не различались. Осложнения 3-4 степени в адъюванте встречались в 2-2,5 раза чаще у пациентов группы стандартного лечения. Трое пациентов погибло в процессе лечения: 1 – в экспериментальной группе и 2 – в стандартной.
Результаты исследования подтверждают, что подобный подход (тотальное неоадъювантное лечение) в ближайшее время изменит стандартную практику лечения местнораспространенного рака прямой кишки по причине более высокой эффективности и лучшей переносимости.
Литература: