14.09.2021

В этом году на ESTRO 2021, который проходил в Мадриде, было представлено большое количество докладов по лучевой терапии рака предстательной железы, в том числе результаты нескольких давно ожидаемых клинических исследований.
Alan Pollack продемонстрировал окончательные результаты исследования RTOG 0534/SPORRT по сальважной лучевой терапии при раке простаты. Было проведено сравнение результатов лечения с применением 3 схем: облучение только ложа предстательной железы до 64,8-70,2 Гр (PBRT), облучение ложа вместе с АДТ в течение 4-6 мес. (PBRT + STAD) и облучение ложа вместе с АДТ и облучением регионарных лимфоузлов таза до 45 Гр (PBRT + STAD + PLNRT). При сравнении 3 групп обнаружено, что в 3 группе комбинация всех 3 модальностей по сравнению с облучением только ложа предстательной железы приводит к статистически достоверному улучшению выживаемости без прогрессирования (87% против 71%, p<0,001, см. рисунок), при этом наилучшие показатели зафиксированы в группе с ПСА >0,35 нг/мл до ЛТ. Также в группе PBRT + STAD + PLNRT гораздо реже у пациентов требовалась повторная сальважная АДТ (8% против 23%). Развитие отдаленных метастазов также реже отмечалось в группе PBRT + STAD + PLNRT по сравнению с PBRT: 4,6% против 8,7% (p<0,001). Количество летальных исходов, связанных с раком предстательной железы, также было ниже в группе PBRT + STAD + PLNRT по сравнению с PBRT: 0,7% против 3,0% (p<0,012), при этом не выявлено статистически достоверных различий в общей выживаемости пациентов. Таким образом, при сальважной лучевой терапии рака предстательной железы есть показания к облучению не только ложа предстательной железы, но и регионарных лимфоузлов, в первую очередь у пациентов с ПСА >0,35 нг/мл до начала лучевой терапии.
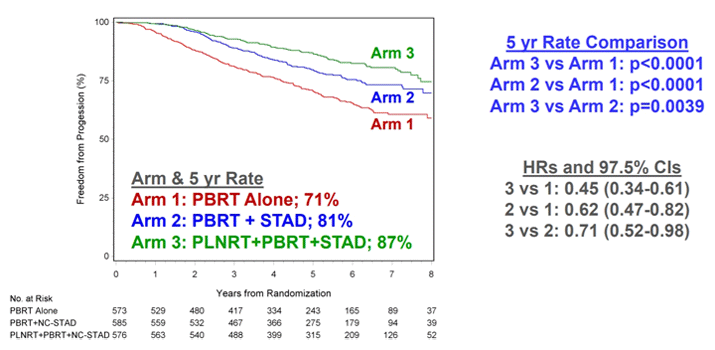
Рисунок. Выживаемость без прогрессирования для всех пациентов (n=1792) в зависимости от схемы лечения.
Также были представлены данные исследования SPORT (Stereotactic PrOstate RadioTherapy) у 30 пациентов с неблагоприятным промежуточным и высоким риском локализованного рака предстательной железы, которые были рандомизированы в группу, где проводилась стереотаксическая аблативная радиотерапия только на предстательную железу с основанием семенных пузырьков (СОД 36,25 Гр с синхронным интегрированным бустом на CTV до 40 Гр и до 45-50 Гр на определяемые по МРТ опухолевые очаги в предстательной железе), и в группу, где пациенты помимо стереотаксического облучения предстательной железы также получали профилактическое облучение регионарных лимфоузлов до 25 Гр за 5 сеансов. У всех пациентов перед разметкой были имплантированы спейсеры и золотые маркеры. Сравнение в этих группах неожиданно показало, что профилактическое облучение регионарных лимфоузлов таза достоверно увеличивало частоту острых и поздних осложнений Grade 2 и выше со стороны мочеполовой системы, но не со стороны кишечника [2].
Представлены данные рандомизированных исследований FLAME/hypoFLAME [3]. В этих проспективных исследованиях II фазы был изучен синхронно-интегрированный буст на «доминантный интрапростатический очаг» (DIL, GTV) до СОД 90 Гр в режиме классического фракционирования (FLAME trial) или в режиме экстремального гипофракционирования до СОД 50 Гр за 5 сеансов (hypoFLAME trial). В обоих случаях СИБ сравнивался со стандартным «гомогенным» облучением всей предстательной железы. Лечение переносилось довольно неплохо: острые осложнения со стороны мочеполовой системы Grade 2 отмечались примерно у 30% пациентов (при этом ни одного случая токсичности Grade 3) и очень редко – со стороны прямой кишки (5% Grade 2, GI toxicity). В исследовании FLAME добавление синхронно-интегрированного буста на GTV привело к улучшению 5-летних показателей биохимического контроля заболевания: 92% против 85%. При этом в исследовании FLAME не было выявлено различий в острой и поздней токсичности между сравниваемыми группами. Также было продемонстрировано, что между дозой на уретру и мочевой пузырь и частотой острых и поздних осложнений есть зависимость, что подтверждает необходимость контролировать дозу на интрапростатическую часть уретры при планировании СИБ на опухоль внутри предстательной железы.
В лекции Michael Zelefsky, посвященной поиску оптимальной аблативной дозы при стереотаксической радиотерапии локализованного рака предстательной железы промежуточной неблагоприятной группы риска, были представлены результаты проспективного исследования ступенчатой эскалации дозы от 32,5 Гр за 5 сеансов до 40 Гр за 5 сеансов, где было продемонстрировано, что увеличение суммарной дозы ведет к достоверному снижению процента обнаруживаемых жизнеспособных опухолевых клеток через 2 года при повторной биопсии (% of positive 2-year biopsy) с 38% до 11%. Снижение частоты «позитивных» биопсий коррелировало со снижением вероятности биохимического рецидива (57% против 7%). При этом именно суммарная доза (<40 Гр против 40+ Гр за 5 сеансов) была наиболее значимым предиктивным фактором в отношении вероятности «позитивной биопсии» через 2 года после SBRT (OR 2,76; p<0,008).
Данные этих исследований и немалое количество других работ по лучевой терапии рака простаты, представленных на ESTRO 2021, еще раз демонстрируют, что требования к качеству проведения облучения при увеличении интенсивности курса (с применением гипофракционирования, ультрагипофракционирования, SBRT) значительно возросли, а подходы к лечению пациентов с раком простаты требуют тщательного рассмотрения в мультидисциплинарной команде.
Ссылки: