06.09.2021

Очередной конгресс ESTRO 2021 проходил в Мадриде в комбинированном (очно и онлайн) формате: около 3 тысяч участников приехали в столицу Испании и примерно столько же участников подключались дистанционно.
Эра ковида примирила нас с временной невозможностью посещать массовые научные мероприятия – но и продемонстрировала одно несомненное преимущество онлайн участия: в любое время, без спешки, без перебежек из зала в зал можно спокойно пролистать все интересующие сессии и сделать пометки для практической деятельности.
При просмотре сессий в записи не создалось впечатления, что конгресс оказался богат на научные прорывы, но некоторые данные могли показаться интересными.
Роль элективного облучения лимфоузлов в 2021 году
В рамках этой сессии докладчики рассмотрели основные доводы в пользу расширенного облучения либо против него при опухолях ряда локализаций.
Для рака легкого стало уже практически очевидным отсутствие необходимости (и целесообразности) облучать все средостение при проведении радикального лучевого или химиолучевого лечения: метаанализ Li et al. 2016 года [1] продемонстрировал отсутствие преимуществ такого подхода в сравнении с селективным облучением только вовлеченных зон лимфоузлов. Отличия в частоте рецидивов в средостении были минимальны, как по данным рандомизированных исследований (6,9% после селективного облучения против 5,0% после широкопольного), так и по данным когортных исследований (4,4% против 3,0%). Основной проблемой остается правильное определение вовлеченных зон. Когда есть возможность использовать ПЭТ/КТ для предлучевой подготовки и оконтуривания, ситуация упрощается. В иных случаях определение именно вовлеченных лимфоузлов (прежде всего, по размеру – 1 см и более в наименьшем изменении) несет определенный процент погрешностей. ESTRO-ACROP рекомендации 2018 года [2] предлагали ориентироваться прежде всего на данные ПЭТ/КТ и морфологическое подтверждение вовлеченности лимфоузлов при биопсии и включать в поле облучения и зоны тех лимфоузлов, которые могли полностью уйти после индукционной химиотерапии. Считалось разумным облучать а) лимфоузлы корня со стороны поражения, б) зону между двумя вовлеченными группами лимфоузлов (хотя это опционально). Обновленные рекомендации 2020 года, основанные на результатах исследования PET-PLAN [3], предлагают полностью отойти от элективного облучения и ориентироваться только на вовлеченные зоны, определяемые по ПЭТ. Оказалось, что риск локорегионального прогрессирования при облучении только вовлеченных зон был не выше, а фактически даже ниже в сравнении с таковым при традиционном элективном облучении [4]. Более того, в эпоху иммунотерапии в консолидирующем лечении рака легкого отказ от широкопольного облучения всех зон лимфоузлов может стать принципиально важным моментом, стимулируя более выраженный иммунный ответ, индуцированный радиотерапией, со стороны необлученных зон лимфоузлов, где вырабатываются иммунокомпетентные лимфоциты [5].
Селективное облучение стало стандартом и для мелкоклеточного рака легкого, хотя рекомендации ESTRO-ACROP 2020 года [6] предлагают включать в поле облучения не только явно увеличенные (более 10 мм) лимфоузлы, но и более мелкие, визуализируемые и располагающиеся рядом – с учетом более высокой агрессивности МРЛ. Недавнее рандомизированное исследование китайских коллег, в котором сравнивались 2 подхода – с облучением вовлеченных зон по данным визуализации ДО химиотерапии и ПОСЛЕ, не показало достоверной разницы в отдаленных результатах [7], но такой подход все же пока выглядит новаторским.
Для пациентов с опухолями головы и шеи пока элективное облучение групп лимфоузлов остается стандартом, хотя в настоящее время, по мнению профессора Vincent Gregoir, мы имеем гораздо больше информации в отношении предиктивного паттерна распространения опухолевых клеток по лимфоузлам шеи из первичного очага и, следовательно, в ближайшем будущем речь однозначно будет идти о селективном воздействии на зоны шейных лимфоузлов (хирургическом или лучевом). В ряде случаев и сегодня при хорошо латерализованных опухолях можно говорить об унилатеральном облучении зон региональных лимфоузлов или, как вариант, о снижении дозы лучевой терапии на зоны низкого риска до 40 Гр, что по данным ряда исследований не отражается на увеличении риска рецидивов, но способствует снижению токсичности [8], но эти данные должны быть валидированы в дальнейших исследованиях.
При раке предстательной железы подход к облучению тазовых лимфоузлов должен быть строго индивидуальным и основанным на конкретных характеристиках опухоли. Крупные исследования разных лет по сравнению облучения только простаты или с включением лимфоузлов таза продемонстрировали различные результаты, но недавние работы (Murthy, 2021 [9], предварительные данные NRG/RTOG 0534) являются доказательством первого уровня, что при раке простаты высокого риска расширение объемов облучения обосновано, в том числе и на послеоперационном этапе при уровне ПСА ≥0,35 нг/мл. По мнению профессора Allan Pollack из университета Майами, в первую очередь кандидатами на радикальное облучение простаты и регионарных лимфоузлов являются пациенты с высоким и очень высоким риском рецидива, причем верхняя граница тазового поля должна располагаться минимум на уровне L4/5, а дозы на простату должны составлять минимум 78 Гр и выше в перерасчете на традиционное фракционирование.
Исследования из категории Proffered Papers
Датские авторы [10] представили данные по анализу уровня и скорости элиминации опухолевой ДНК в качестве предиктора рецидивов у больных с первичным раком анального канала. В исследование были включены 45 больных с ВПЧ-позитивным плоскоклеточным раком анального канала, которые получали радикальное химиолучевое (более 70%) или лучевое лечение. До начала лечения, в середине курса, по его окончании, а также спустя 1-3 года после его окончания в плазме крови определяли опухолевую ДНК, и по скорости ее элиминации из плазмы распределили больных в 3 группы – группу быстрой элиминации (когда уже к середине курса ДНК не определялась), медленной элиминации (ДНК переставала регистрироваться к концу курса) и группу персистенции, когда ДНК продолжала определяться на протяжении всего периода наблюдения.
Средний период наблюдения составил 29 месяцев, за это время у 4 больных (8%) возникли локальные рецидивы, у 4 (8%) – отдаленные метастазы. При этом в 1 группе (12 пациентов) признаков прогрессирования не отмечено вообще, во 2 группе (медленной элиминации – 20 больных) отмечены 4 случая локальных рецидивов, а в 3 группе (13 больных) – все 4 случая отдаленного метастазирования, что свидетельствует о персистенции опухолевой ДНК после лечения как о факторе негативного прогноза. Соответственно, тактика ведения таких пациентов может различаться: группу быстрой элиминации целесообразно просто наблюдать, при медленной элиминации ДНК стоит рассмотреть возможность локального буста для улучшения локального контроля, а в группе персистенции – необходимость проведения дополнительного более агрессивного системного лечения.
Интересные данные в отношении комбинации стереотаксической лучевой терапии (SBRT) и таргетной терапии представили авторы из Швейцарии [11]. Исследование TOasTT – пока единственное проспективное мультицентрическое (27 центров Европы и Австралии) исследование, поставившее целью определить токсичность комбинации различных групп таргетных и иммунных препаратов и концентрированной лучевой терапии у больных с отдаленными метастазами. До сих пор информация была крайне противоречивой, с упоминанием немалого количества выраженных осложнений, поэтому тема однозначно актуальна. Было включено 438 больных, из них большинство – с полиметастатическим процессом (58%), которые получали различные варианты таргетной терапии и SBRT как на интракраниальные, так и на экстракраниальные очаги. Большинство пациентов имели НМРЛ и меланому (37% и 36%), меньшее количество – рак почки (8%), рак молочной железы (6%) и опухоли других локализаций (13%). Наиболее часто проводилось облучение интракраниальных метастазов, из препаратов чаще всего пациенты получали иммунотерапевтические агенты (50% случаев). Как правило, лекарственное лечение было начато до облучения и продолжено на его фоне; в ряде случаев в период облучения оно было прервано и редко – начато после лучевой терапии. Перерыв в лечении никак не сказался на частоте и выраженности осложнений, и в подавляющем большинстве случаев клинически значимая токсичность (3 степени), как ранняя, так и поздняя, не превышала 10% – уровень, который считается допустимым. Только комбинация SBRT с BRAF/MEK ингибиторами показала превышение частоты выраженных осложнений свыше 10% (см. рисунок). Преобладала внутримозговая токсичность, ранняя и поздняя, это касалось нескольких групп препаратов (BRAF/MEK, ALKi, PD-L1i, EGFRi, HER2i). Экстракраниальная SBRT чаще сопровождалась осложнениями со стороны грудной клетки (EGFRi, mTKIi) и брюшной полости (PD-L1i).
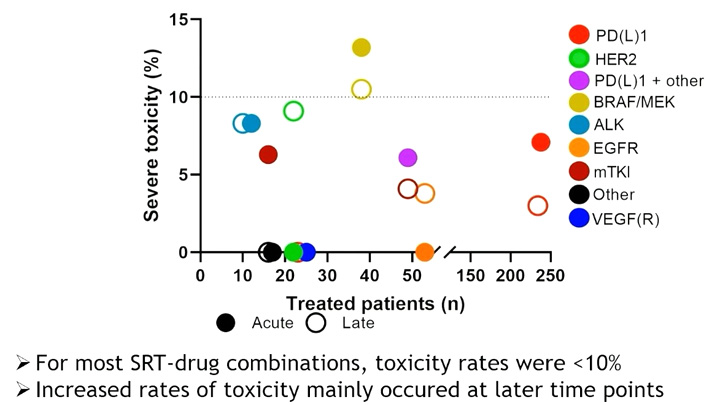
Рисунок. Ранняя и поздняя токсичность комбинации таргетных агентов или иммунопрепаратов с SBRT [11].
Исследователи из парижского института Марии Склодовской-Кюри представили одногодичные данные [12] по токсичности комбинации олапариба и лучевой терапии у больных с трижды негативным раком молочной железы (проспективное исследование RADIOPARP 1 фазы с эскалацией дозы олапариба с 50 мг дважды в сутки до 200 мг на фоне стандартной лучевой терапии 50 Гр ± буст). Олапариб уже продемонстрировал эффективность в лечении этой сложной группы пациентов, снижая риск прогрессирования на 57% (по данным исследования OlympiAD) и увеличивая выживаемость без прогрессирования у пациенток с BRCA мутацией. Но безопасность комбинации препарата с лучевой терапией пока не оценена. В исследование были включены больные с неполным патоморфологическим регрессом после неоадъювантной ХТ, с нерезектабельным процессом после ХТ и с контролируемым метастатическим процессом, которым было принято решение проводить местное лечение – всего 24 пациентки. Ранняя токсичность была вполне умеренная: у 2 больных – кожная токсичность 3 степени, у 1 – болевой синдром в молочной железе 3 ст. У 46% (11 больных) отмечена купируемая лейкопения 3-4 степени. Спустя 1 год осложнений 3 степени и выше не зарегистрировано. В итоге олапариб в дозе 200 мг BID был рекомендован для изучения эффективности в комбинации с лучевой терапией в дальнейших исследованиях 2 фазы.
Американские исследователи из Пенсильвании решили оценить эффективность адъювантного лечения у больных низкодифференцированным раком эндометрия и светлоклеточными карциномами с глубокой инвазией [13]. Для анализа использовались результаты лечения 7680 пациенток за период 2004-2016 гг., взятые из Национальной раковой базы данных США. Треть из них не получали никакого адъювантного лечения, у остальных варианты терапии включали дистанционное облучение малого таза (26,5%), вагинальную брахитерапию (16,3%), комбинацию ДЛТ и ХТ (7,3%), вагинальную ЛТ и ХТ (9,7%) и только ХТ (7,2%). При этом предпочтение варианту вагинального облучения отдавалось у более пожилых пациенток с более высоким индексом коморбидности, проживающим преимущественно в отдалении от городов, после лапароскопических оперативных вмешательств, лимфаденэктомий и в тех случаях, когда пациенткам изначально предполагалось проведение ХТ. Наилучшие показатели 5-летней общей выживаемости оказались в группах больных, у которых один из вариантов лучевой терапии сочетался с ХТ (кривые практически совпали, ОВ за 5 лет составила 75,0% и 74,8% после ДЛТ+ХТ и ВПЛТ+ХТ соответственно). Чуть хуже результаты оказались в группе изолированного адъювантного лучевого лечения (72,3% после ДЛТ и 71,0% после ВПЛТ) и худшие результаты – после ХТ в качестве единственной адъювантной терапевтической опции (67,9%). В России в подобных клинических ситуациях более распространен вариант сочетанной лучевой терапии на адъювантном этапе, но данные этого исследования демонстрируют целесообразность сочетания локального облучения и лекарственной терапии для улучшения отдаленных результатов.
Ссылки: