03.09.2021



Рак желудка занимает 6 место по заболеваемости и второе место по уровню смертности во всем мире, при этом лекарственная терапия рака желудка является актуальной проблемой современной онкологии [1]. До недавнего времени химиотерапия являлась основным методом системной терапии больных метастатическим раком желудка, медиана общей выживаемости (ОВ) составляла менее 1 года [2]. За последние несколько лет был достигнут значимый успех применения иммунотерапии в лечении солидных опухолей, включая рак желудка. Проведенные к настоящему времени рандомизированные исследования и исследования в реальной практике показали целесообразность назначения иммунотерапии ниволумабом в поздних линиях лечения распространенного рака желудка [3,4], что послужило основанием для изучения ингибиторов контрольных точек иммунного ответа в качестве первой линии терапии.
Так, в многоцентровом рандомизированном клиническом исследовании 3 фазы CHECKMATE-649 (NCT02872116) была оценена эффективность и переносимость ниволумаба в комбинации со стандартной химиотерапией в качестве первой линии терапии распространенного рака желудка [5]. В исследование был включен 1581 пациент, ранее не получавший терапию по поводу распространенного или метастатического рака желудка, желудочно-пищеводного перехода или аденокарциномы пищевода.
Пациенты случайным образом были рандомизированы в соотношении 1:1 в группу ниволумаба в комбинации с химиотерапией (ниволумаб в дозе 360 мг с CapeOX каждые 3 недели или ниволумаб в дозе 240 мг с FOLFOX каждые 2 недели, n=789) или в группу только химиотерапии (режимы CapeOX или FOLFOX, n=792).
Первичными конечными точками исследования были общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП) у пациентов с PD-L1 CPS ≥5, в то время как вторичной конечной точкой была ОВ у всех рандомизированных пациентов. Шестьдесят процентов больных имели PD-L1 CPS ≥5.
Медиана ОВ в группе пациентов, получавших ниволумаб в комбинации с химиотерапией, составляла 14,4 месяца у пациентов с PD-L1 CPS ≥5 в сравнении с 11,1 месяца в группе, получавшей только химиотерапию (отношение рисков (ОР) 0,71; 95% ДИ 0,61-0,83; P<0,0001). Кроме того, статистически значимое улучшение ОВ было также продемонстрировано для всех рандомизированных пациентов (n=1581) независимо от уровня CPS. Так, медиана общей выживаемости в группе пациентов, получавших иммунотерапию в комбинации с химиотерапией, по сравнению с группой только химиотерапии составила 13,8 месяца (95% ДИ 12,6-14,6) и 11,6 месяца (95% ДИ 10,9-12,5) соответственно (ОР=0,80; 95% ДИ 0,71-0,9; P=0,0002).
Медиана ВБП составила 7,7 месяца (95% ДИ 7,0-9,2) в группе ниволумаба и химиотерапии по сравнению с 6,0 месяца (95% ДИ 5,6-6,9) в группе только химиотерапии (ОР=0,68; 95% ДИ 0,58-0,79; p<0,0001).
Таким образом, назначение ниволумаба в комбинации с химиотерапией у пациентов с ранее нелеченым распространенным или метастатическим раком желудка, раком желудочно-пищеводного перехода или аденокарциномой пищевода в первой линии позволило снизить риск смерти на 29% у пациентов с экспрессией PD-L1 (CPS) ≥5 . Более того, ниволумаб в комбинации с химиотерапией также приводил к снижению риска прогрессирования заболевания или смерти на 32% по сравнению с одной химиотерапией (HR 0,68; 95% ДИ 0,56-0,81; P<0,0001).
Наиболее частыми нежелательными явлениями (частота ≥20%), наблюдаемыми у пациентов, получавших ниволумаб в сочетании с фторпиримидин- и платиносодержащей химиотерапией, были периферическая нейропатия, тошнота, усталость, диарея, рвота, снижение аппетита, боли в животе, запоры и боли в опорно-двигательном аппарате. Терапия ниволумабом также может сопровождаться иммуноопосредованными нежелательными явлениями, такими как пневмонит, колит и гепатит, а также эндокринопатии и нефрит.
Основываясь на результатах исследования CHECKMATE-649, в апреле 2021 года FDA одобрило ниволумаб в комбинации с фторпиримидин- и платиносодержащей химиотерапией в качестве первой линии терапии распространенного или метастатического рака желудка, рака желудочно-пищеводного перехода и аденокарциномы пищевода [4].
Рекомендуемые режимы лечения и дозы ниволумаба: 360 мг каждые 3 недели в сочетании с химиотерапией, содержащей фторпиримидин и платину, каждые 3 недели; 240 мг каждые 2 недели в сочетании с химиотерапией, содержащей фторпиримидин и платину, каждые 2 недели.
Результаты исследования суммированы в таблице.
| Ниволумаб + химиотерапия | Плацебо + химиотерапия | |
|---|---|---|
| Число пациентов | 789 | 792 |
| Число пациентов с CPS ≥5 | 60% | 61% |
| ВБП в общей группе пациентов, медиана | 7,7 мес. | 6,9 мес. |
| ВБП в группе пациентов с экспрессией PD-L1, медиана | 7,7 мес. | 6,0 мес. |
| ОВ в общей группе пациентов, медиана | 13,8 мес. | 11,6 мес. |
| ОВ в группе пациентов с экспрессией PD-L1, медиана | 14,4 мес. | 11,1 мес. |
| Частота объективных ответов | 58% | 46% |
| Частота полных ответов | 10% | 6% |
| Длительность ответа в общей группе пациентов, медиана | 8,5 мес. | 6,9 мес. |
На основании этих результатов в Институте онкологии Хадасса Москва было принято решение об использовании в первой линии терапии метастатического HER2-негативного рака желудка иммунотерапии в комбинации с химиотерапией.
Клинический случай
Пациентка Б, 31 год.
С апреля 2020 года больную периодически беспокоили спастические боли в животе, вздутие. Пациентке проводилась симптоматическая терапия без эффекта. В связи с карантином по поводу COVID-19 дополнительное обследование выполнено не было.
В марте 2021 г. отмечено появление тошноты, рвоты съеденной пищей, по поводу чего больная госпитализирована в стационар с клиникой кишечной непроходимости. При дообследовании было выявлено образование в антральном отделе желудка с инвазией в печеночный изгиб ободочной кишки, анемия II ст. (HB 88 г/л). 13 марта 2021 было выполнено экстренное хирургическое лечение в объеме субтотальная дистальная резекция желудка, правосторонняя мезоколэктомия, лимфаденэктомия D3.
Гистологическое заключение: низкодифференцированная аденокарцинома привратника желудка, с диффузным характером роста, изъязвлением, лимфоваскулярной и венозной инвазией, распространяющаяся на стенку двенадцатиперстной кишки, прорастающая стенку желудка, врастающая в клетчатку большого сальника, желудочно-ободочную связку, в стенку толстой кишки. В 34 из 43 регионарных лимфатических узлов – метастазы карциномы, в 8 лимфатических узлах аортокавального промежутка и узлах вдоль верхней брыжеечной вены – метастаз карциномы.
При иммуногистохимическом исследовании отсутствует экспрессия HER-2 на опухолевых клетках. Микросателлитная нестабильность не обнаружена. Статус опухоли PD-L1 – отрицательный.
Таким образом, по результатам дообследования больной был установлен диагноз – рак желудка pT4bpN3bM1 с множественными метастазами в региональные и отдаленные лимфатические узлы.
По данным КТ органов грудной клетки, брюшной полости, малого таза (до начала химиотерапии): на уровне всей брюшины аорты парааортально, прекавально, аортокавально – конгломерат увеличенных лимфатических узлов. Прекавально – аваскулярное жидкостное образование, размерами до 40×28 мм. Аналогичное образование размерами до 25×25 мм выявлено в области серповидной связки печени. На уровне почечной артерий справа – шовный материал, сама почечная артерия не визуализируется. При контрастировании в правой почке множественные гиподенсивные аваскулярные участки плотностью вплоть до жидкостной. На уровне и кпереди верхней 1/3 левого мочеточника прослеживается поперечно направленная ветвь маточной вены с признаками супрастенотического расширения ЧЛС (чашечки – 9-10 мм, лоханка – 23 мм). Петли кишечника диффузно с горизонтальным уровнем содержимого – признаки пареза. В полости малого таза, межпетельно – минимальный выпот. Размеры печени увеличены до 207×100×134 мм. Селезенка увеличена до 100×53×73 мм. Матка смещена влево, при контрастировании определяются извитые сосуды маточного сплетения.
С апреля 2021 года начата химиотерапия в режиме FOLFOX (оксалиплатин 85 мг/м2 в/в + кальций фолианата
По данным контрольного обследования ПЭТ-КТ в августе 2021 года (после 7 циклов химиотерапии и иммунотерапии) – ПЭТ/КТ данных о наличии очагов/ткани с патологическим метаболизмом 18F-ФДГ, характерной для опухолевого процесса, не получено.
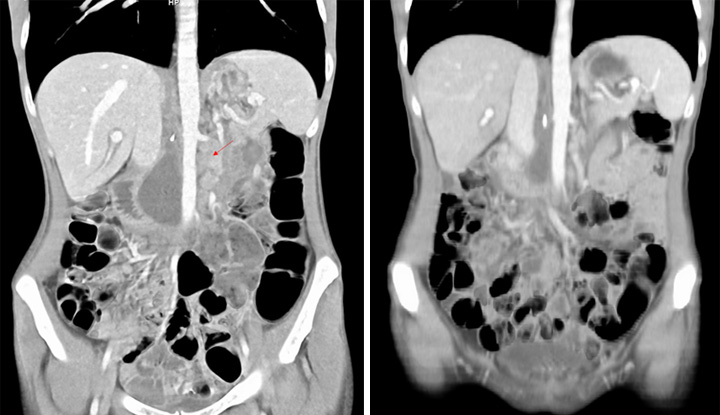
Рисунок. КТ исследование до начала лечения ниволумабом и химиотерапией и через 4 месяца.
При оценке безопасности совместного применения иммунотерапии и химиотерапии увеличения степени ранее выявленных и появления новых нежелательных явлений отмечено не было.
Таким образом, назначение ниволумаба в комбинации с химиотерапией у пациентов с ранее нелеченым распространенным или метастатическим раком желудка в первой линии терапии открывает новые возможности лечения, позволяет добиться ответа на терапию, снизить риск смерти и прогрессирования заболевания по сравнению с только химиотерапией, которая была стандартом на протяжении десятилетий.
Конфликт интересов
Авторы не имеют конфликта интересов, не получали вознаграждений за подготовку данной статьи. Назначение ниволумаба по незарегистрированному показанию проводилось в рамках федерального закона №160.
Источники: