19.08.2021

Большинство женщин хотели бы стать матерями. Материнство – это, в первую очередь, выбор женщины, но иногда статус «childfree» является заданной ситуацией. В современном мире многие женщины по карьерным или иным соображениям не спешат с рождением детей: так, в Российской Федерации средний возраст женщины при рождении первенца – 28,5 лет [15]. Заболеваемость раком молочной железы (РМЖ) среди женщин моложе 40 лет составляет 6-7% [1, 6], и далеко не каждая к этому возрасту является матерью и не планирует больше детей.
Не только в России, но и во всем мире, беременность и РМЖ ассоциированы с такими стигмами, как:
В 2013 году был опубликованы результаты опроса, проведенного среди акушеров-гинекологов и онкогинекологов из 14 стран Европы. Оказалось, что 44% опрошенных рекомендовали прерывание беременности при выявлении онкологического заболевания, 58% – преждевременное родоразрешение с целью начала активной терапии в послеродовом периоде и 37% респондентов считали нецелесообразным проведение химио- или лучевой терапии во время беременности [9].
Хотелось бы верить, что с 2013 года мнение онкологов и онкогинекологов изменилось.
По данным различных исследований, доля пациенток с хотя бы одной доношенной беременностью после постановки диагноза РМЖ составляет 3% для женщин моложе 45 лет и 8% для женщин моложе 35 лет [7].
Несомненно, каждый случай беременности женщины с анамнезом РМЖ должен тщательно наблюдаться в перинатальном центре под контролем опытных акушеров-гинекологов во взаимодействии с онкологом. Беременность у пациенток после лечения РМЖ значимо чаще ассоциирована с преждевременными родами (ОР=1,56; 95% ДИ 1,37-1,77), низким весом ребенка при рождении (ОР=1,47; 95% ДИ 1,24-1,73), экстренным родоразрешением путем кесарева сечения (ОР=1,22; 95% ДИ 1,15-1,30) и послеродовым кровотечением (ОР=1,18; 95% ДИ 1,02-1,36) [8].
Беременность после радикального лечения РМЖ не ухудшает отдаленные результаты терапии, прогноз РМЖ определяется в первую очередь распространенностью РМЖ и его молекулярно-биологическим подтипом [2-4].
Впервые это было продемонстрировано в ретроспективном исследовании 2011 года [10], которое оценивало влияние беременности на общую выживаемость (ОВ) женщин, излеченных от рака молочной железы. В работе было показано, что беременность у пациенток с РМЖ в анамнезе позволила снизить риск смерти от РМЖ на 41% (ОР=0,59; 90% ДИ 0,50-0,70). Этот результат, вероятно, объясняется особенностью отбора, известного как «эффект здоровой матери»: только здоровые женщины, излеченные от РМЖ, смогли зачать и выносить ребенка.
В 2018 году были опубликованы результаты многоцентрового исследования «случай-контроль» Lambertini и соавторов [11], основной задачей которого была оценка безрецидивной выживаемости пациенток, забеременевших после лечения РМЖ. В работу было включено 1207 пациенток с РМЖ в анамнезе, 333 женщины забеременели после завершения терапии и 874 пациенток были включены в контрольную группу. При медиане наблюдения в 9,6 лет было показано что беременность не является фактором риска рецидива РМЖ ни в группе с положительными ЭР (ОР=0,94, 95% ДИ 0,70-1,26, р=0,68), ни в группе с отрицательными ЭР (ОР=0,75, 95% ДИ 0,53-1,06, р=0,10). Беременность также не оказывала влияния на ОВ пациенток с ЭР позитивным РМЖ (HR=0,84, 95% ДИ 0,60-1,18, р=0,32), но оказывала значимое протективное действие у пациенток с ЭР негативными подтипом опухоли (HR=0,57, 95% ДИ 0,36-0,90, р=0,01) (рис.1).
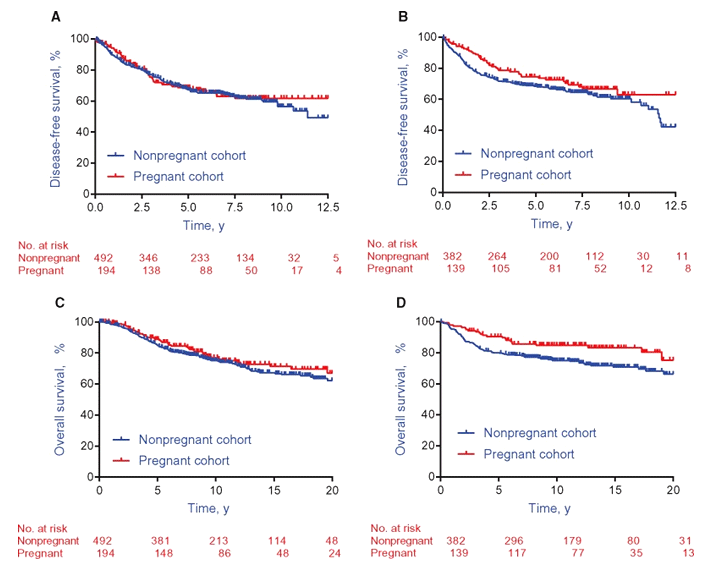
Рисунок 1. Влияние беременности на общую и безрецидивную выживаемость
больных РМЖ в зависимости от рецепторного статуса [11].
А) ВБП у пациенток с ЭР+ РМЖ; В) ВБП у пациенток с ЭР- РМЖ;
С) ОВ у пациенток с ЭР+ РМЖ; D) ОВ у пациенток с ЭР+ РМЖ.
При подгрупповом анализе не было отмечено влияния на безрецидивную выживаемость таких факторов, как время до наступления беременности (ОР=1,12, 95% ДИ 0,82-1,54, р=0,47), прерывание беременности (ОР=0,80, 95% ДИ 0,56-1,13, р=0,20) и грудное скармливание (ОР=0,70, 95% ДИ 0,26-1,94, р=0,50).
В представленной работе 30% женщин прервали беременность; с чем связан такой высокий процент абортов – сказать затруднительно, возможно, это решение женщины, но высока вероятность и некоторого «поощрения» аборта врачом [11].
Особое опасение женщины вызывает риск рождения ребенка с пороком развития. По данным литературы, в общей популяции доля детей с врожденными пороками развития внутренних органов составляет 5-8% от всех живорожденных детей [14]. В метаанализ 2021 года было включено 112 840 женщин с РМЖ в анамнезе, из которых 7505 забеременели после лечения. В работе показано, что риск рождения ребенка с пороками развития у женщин после терапии сопоставим с общей популяцией [15].
Остается неясным, какой интервал без лечения до наступления беременности необходимо соблюсти, чтобы минимизировать риски. Большинству женщин рекомендуется отложить беременность как минимум на 2 года после лечения, так как именно в этот период риск рецидива максимален.
Есть несколько препаратов, для которых сроки от завершения терапии до беременности оговорены достаточно определенно, так как они могут оказывать негативное влияние на развитие плода.
Трастузумаб
Особую группу пациенток составляют женщины с HER2-позитивным РМЖ. Трастузумаб является гуманизированным моноклональным антителом, относящимся к IgG1, проникающим через плацентарный барьер. В настоящее время считается, что трастузумаб не оказывает прямого тератогенного воздействия на плод, но может увеличить риск внутриутробных инфекций и смерти плода за счет уменьшения количества амниотической жидкости. Малый объем амниотической жидкости в свою очередь приводит к нарушению пренатального формирования органов дыхания плода. Таким образом, женщины, получавшие трастузумаб в адъювантном режиме по поводу HER2-положительного РМЖ, должны использовать эффективную контрацепцию в течение не менее семи месяцев после последнего введения трастузумаба.
Тамоксифен
Тамоксифен является нестероидным селективным модулятором эстрогеновых рецепторов. Тамоксифен, а также некоторые его метаболиты конкурируют с эстрадиолом за сайты связывания с цитоплазматическими рецепторами эстрогена, что приводит к изменению транскрипции и трансляции. В нескольких крупных ретроспективных работах была показана высокая частота внутриутробных пороков развития при применении женщинами тамоксифена во время беременности [12,13]. В настоящий момент, с учетом периода полувыведения тамоксифена, пациенткам рекомендовано планировать беременность через 2-3 месяца после отмены препарата.
Заключение
Беременность женщины, излеченной от РМЖ, является нечастой ситуацией. Каждый такой случай должен рассматриваться индивидуально в контексте возраста пациентки, распространенности РМЖ, молекулярно-биологического подтипа опухоли, проводимой на данной момент терапии (тамоксифен, трастузумаб) и обсуждаться с пациенткой и ее семьей. Исход беременности и родов в этой группе женщин, как правило, благоприятный, а сам факт беременности не увеличивает частоту рецидивов заболевания.
Источники: