05.07.2021


С 4 по 8 июня 2021 года состоялась очередная конференция Американского общества клинической онкологии (American Society of Clinical Oncology, ASCO). В данном обзоре мы представляем наиболее значимые исследования, которые касались раннего рака молочной железы.
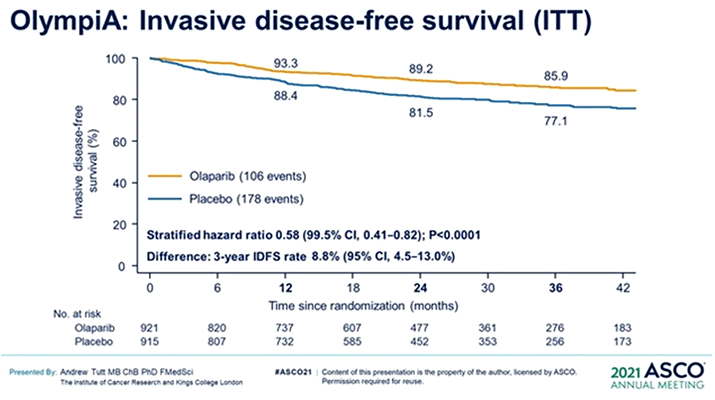
1) Одними из наиболее ожидаемых были промежуточные результаты исследования III фазы OlympiA (Abstract LBA01).
Исследование посвящено изучению эффективности применения PARP-ингибитора олапариба в сравнении с плацебо у больных ранним gBRCAm HER2-негативным РМЖ группы высокого риска в адъювантном режиме. Набор в исследование велся с 2014 года и суммарно проанализированы данные 1836 пациенток высокого риска, под которым авторы понимали следующее:
Пациентки рандомизировались 1:1 и в адъювантном режиме в течение года принимали олапариб или плацебо. При люминальном подтипе допускалось применение олапариба на фоне АГТ ± золендроновая кислота (спустя год исследования прием АГТ продолжался). При тройном негативном (ТН) подтипе РМЖ с резидуальной опухолью не назначался капецитабин в адъювантном режиме в связи с отсутствием доказанной эффективности на момент начала исследования.
Были доложены следующие результаты: при медиане наблюдения в 2,5 года 3-летняя выживаемость без инвазивных проявлений заболевания (ВБиП) составила 85,9% в группе олапариба и 77,1% в группе плацебо (95% ДИ 4,5-13,0), риск рецидива или смерти был на 42% статистически достоверно ниже в группе олапариба по сравнению с плацебо (95% ДИ 0,41-0,82; p<0,001). 3-летняя выживаемость без отдаленных метастазов составила 87,5% в группе олапариба и 80,4% в группе плацебо (95% ДИ 3,0-11,1; ОР отдаленного метастазирования и смерти 0,57 [95% ДИ 0,39-0,83; p<0,001]). В группе олапариба наблюдалось меньшее количество смертей (59 Ола против 86 Пл), хотя достичь заданную границу достоверности при р<0,01 не удалось (ОР=0,68; 95% ДИ 0,44-1,05; р=0,02).
Профиль нежелательных явлений при приеме олапариба в представленном исследовании был схож с результатами прошлых исследований препарата. Более 1% пациенток имели проявления токсичности 3 степени в виде анемии (8,7%), нейтропении (4,8%), лейкопении (3,0%) и усталости (1,8%). Частота серьезных нежелательных явлений и побочных эффектов, включая миелодиспластический синдром или острый миелоидный лейкоз, злокачественного новообразования (8,7% против 8,4%) и пневмонита (2,6% против 4,6%), не увеличивалась у пациентов в группе олапариба.
2) Представлены результаты исследования II фазы NEOTALA (Abstract 505).
Активно ведется изучение и другого PARP ингибитора – талазопариба, который уже зарегистрирован для применения при местнораспространенном и метастатическом HER2-негативном раке молочной железы с наличием gBRCAm. В представленной работе изучалась эффективность и переносимость талазопариба в неоадъювантном режиме у пациенток с ТН подтипом раннего рака молочной железы, имеющих gBRCA1/2m. Целью исследования была центральная независимая оценка достижения полного патоморфологического ответа (pCR) через 24 недели неоадъювантной терапии талазопарибом с последующим оперативным лечением. Всего в исследование включена 61 пациентка, однако оценка эффекта проводилась только у группы получивших не менее 80% суммарной дозы талазопариба с момента включения до оценки pCR и у пациенток, запрогрессировавших до момента оценки патоморфоза (N=48).
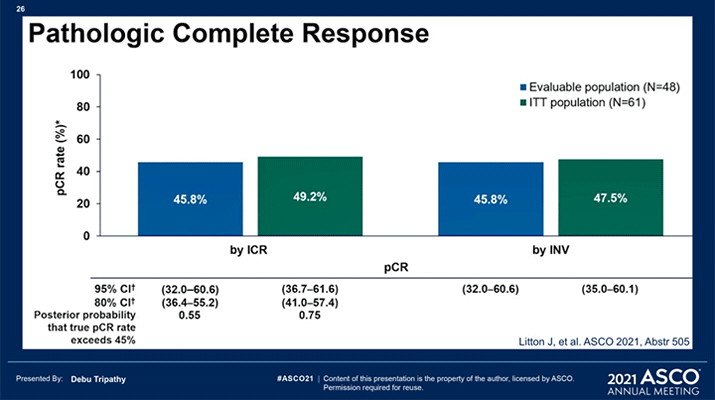
По результатам исследования можно сделать вывод, что талазопариб имеет удовлетворительный профиль токсичности. Среднее время приема препарата 23,3 недели, средняя кумулятивная доза 84,5%. Из нежелательных явлений отмечались усталость у 78,7% (3 степени – 3,3%), тошнота у 68,9% (3 степени – 1,6%), алопеция у 57,4% (2 степени – 3,3%), 2 пациентки прекратили лечение в связи с анемией 3 степени и 1 пациентка – в связи с головокружением 3 степени.
Результаты достижения полных патоморфологических ответов можно детально рассмотреть в предложенной таблице.
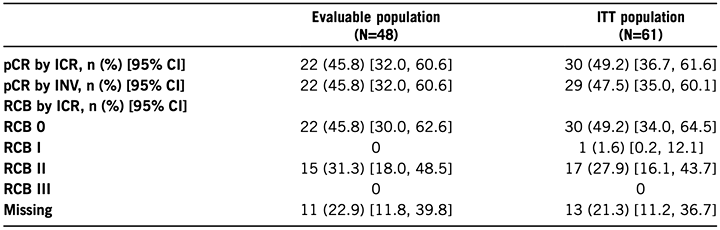
* ICR – центральное независимое агентство; INV – исследовательский центр.
В выводах авторы отмечают, что талазопариб в неоадъювантном режиме хорошо переносится пациентами и имеет сопоставимые данные достижения полного патоморфологического ответа по сравнению со стандартными режимами НАХТ, включающими антрациклины и таксаны.
3) Не менее интересным также был первый анализ общей выживаемости исследования WSG-ADAPT HR-/HER2+, представленный в ходе конгресса N. Harbeck (Abstract 503).
Исследование было направлено на изучение возможности деэскалации лечения при раннем HER2-позитивном нелюминальном раке молочной железы.
Всего включены 134 пациентки с cT1-T4c, cN0-3, HR-, HER2-позитивные, 60% из которых имели сТ2-4, 42% имели клинически пораженные лимфоузлы. Случайным образом пациентки рандомизировались на 2 группы: первая группа получала в неоадъювантном режиме 4 курса химиотаргетной терапии трастузумабом и пертузумабом с добавлением паклитаксела еженедельно 12 введений, а вторая группа получала таргетную терапию по той же схеме, но без применения паклитаксела. Оперативное лечение начиналось спустя 3 недели после окончания лекарственной терапии. Если было достижение pCR, то по решению исследователя адъювантная химиотерапия могла не проводиться.
Ранее уже были доложены результаты по первичной конечной точке, которой являлась частота полного патоморфологического ответа (ypT0/is, ypN0). Стоит учесть, что в группе только таргетной терапии учитывались исключительно пациентки, имеющие ранний ответ, что расценивалось как низкая клеточность (менее 500 клеток опухоли в поле зрения) и/или снижение ki67 более чем на 30% при повторной биопсии опухоли через 3 недели от начала лечения. Были достигнуты следующие значения: 90% pCR в группе химиотаргетной терапии и 34% в группе без применения химиопрепаратов. Стоит отметить, что у пациенток с HER2 low, под которым понимали 1+; 2+ по ИГХ и позитивных по FISH (ориг. IHC 1+/2+ and FISH positive) и/или с базально-подобным подтипом (подтвержденным PAM50), не было зафиксировано ни одного полного патоморфоза.
Столь выраженная разница, казалось бы, должна была отрицательно повлиять на отдаленные показатели выживаемости, однако вернемся к текущему докладу, где представлены первые отдаленные результаты. При медиане наблюдения в 5 лет не было достоверной разницы в выживаемости между исследуемыми группами (триплет против дуплета): ВБП 98% и 87% соответственно (ОР=0,32; р=0,144); выживаемость без отдаленных проявлений болезни (ВБоП) 98% и 92% соответственно (ОР=0,34; р=0,313); общая выживаемость (ОВ) 98% и 94% соответственно (ОР=0,41; р=0,422). Отмечается, что пациентки, достигшие pCR (N=69), имели лучшие показатели 5-летней выживаемости без инвазивных проявлений болезни независимо от группы: 98% и 82% соответственно (ОР=0,14; р=0,011). Также отмечается ухудшение результатов ВБоП (р=0,029) и безинвазивной выживаемости (р=0,068) у пациенток с HER2 low и/или без раннего ответа на проводимую терапию.
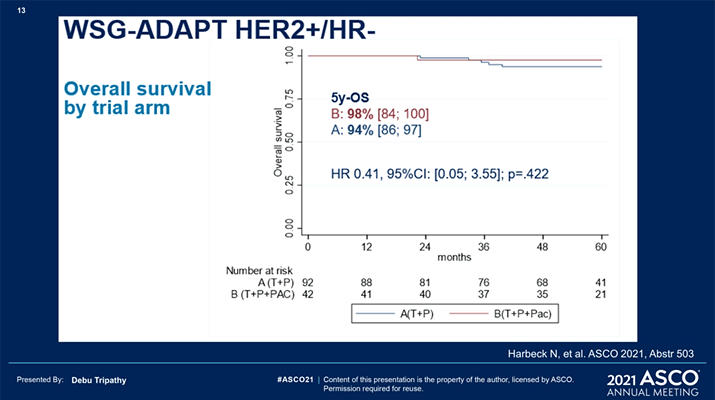
Вопрос о деэскалации режимов химиотерапии при высокочувствительных опухолях все еще остается открытым, необходимо больше результатов подобных исследований с похожим дизайном, некоторые из которых уже ведутся – COMPASS и DECRESCENDO.
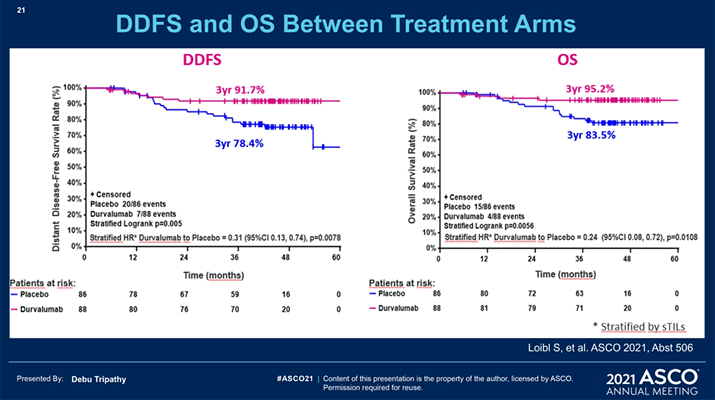
4) Представлены отдаленные результаты исследования II фазы GeparNuevo (Abstract 506).
В представленной работе изучается анти-PD-L1 чекпоинт ингибитор дурвалумаб в комбинации с неоадъювантной химиотерапией при ТН РМЖ. Основной целью исследования было увеличение частоты достижения полного патоморфологического ответа.
В исследование включались прежде не леченные пациентки с ТН РМЖ и первичной опухолью >2 см. Перед началом лечения, с целью стратификации, оценивался уровень стромальных инфильтрирующих опухоль лимфоцитов (сИОЛ), статус PD-L1, а также уровень ki67. Всего рандомизированы 174 пациентки в 2 группы, которые получали неоадъювантную химиотерапию по схеме: 12 курсов наб-паклитаксела еженедельно и затем 4 курса EC (эпирубицин/циклофосфамид), сопровождающихся дурвалумабом 1 раз в 4 недели в 1 группе. Иммунотерапию начинали с одной дозы дурвалумаба за 2 недели до основного блока химиотерапии, что исследователи прозвали «фазой окна» (режим с «окном» был закрыт независимым комитетом после набора в исследование 117 пациенток в связи с долгим временем до начала химиотерапии – в среднем 47,7 дней).
Ранее уже были доложены первые результаты. Полный патоморфоз (ypT0; ypN0) был достигнут у 53,4% в группе дурвалумаба и у 44,2% в группе плацебо (ОР 1,45; 95% ДИ 0,80-2,63; р=0,224). Эффект иммунотерапии наиболее ярко проявил себя при сравнении групп с двухнедельным «окном» и без него: pCR 61% против 41,4% в контрольной группе (ОР 2,22; 95% ДИ 1,06-4,64; р=0,035). Отмечена связь с уровнем сИОЛ при оценке до начала лечения: при высоком уровне (>60%) pCR достигался чаще независимо от группы (ОР 3,09; 95% ДИ 1,12-8,52; р=0,005). Статус PD-L1 также имел значение. Во всей популяции больных pCR достигнут у 54,3% пациенток, имеющих позитивный статус, и у 30% с негативным (р=0,048).
Новые данные освещают отдаленные результаты. При медиане наблюдения в 42,2 месяца 3-летняя выживаемость без инвазивных проявлений заболевания (ВБиП) в группе пациенток, достигших pCR, была 92% против 71,9% у не достигших (ОР 0,54; 95% ДИ 0,27-1,09; р=0,0559); 3-летняя выживаемость без отдаленных метастазов – 91,4% в группе дурвалумаба и 76,9% в группе плацебо (ОР 0,37; 95% ДИ 0,15-0,87; р=0,0148); 3-летняя ОВ – 95,1% и 83,1% соответственно (ОР 0,26; 95 ДИ 0,09-0,79; р=0,0076). Не отмечено статистически значимой разницы в ВБиП, выживаемости без отдаленных метастазов и ОВ в группах, получивших 2-недельное «окно» перед курсом ХТ и без него.
Выводы авторов: дурвалумаб в комбинации с химиотерапией, несмотря на незначительный прирост в pCR и отсутствие адъювантного лечения, улучшил отдаленные результаты.
Список литературы: