27.04.2021
Комбинация химио- и иммунотерапии активно изучается и внедряется в рутинную клиническую практику при различных солидных опухолях, рак желудка (РЖ) – не исключение. Однако до 2020 года успехи иммунотерапии РЖ были скромными.
С 2017 г. на основании результатов исследований ATTRACTION-2 и CheckMate-032 ниволумаб в монотерапии, вне зависимости от уровня PD-L1 или СPS, является вариантом выбора в поздних линиях лечения больных РЖ [1, 3].
16 апреля 2021 г. FDA (Food and Drug Administration) на основе результатов исследований ATTRACTION-4 и CheckMate 649 одобрило ниволумаб в комбинации с химиотерапией в первой линии лечения пациентов диссеминированным и местнораспространенным РЖ независимо от уровня PD-L1 или СPS.
ATTRACTION-4
В исследовании 3 фазы ATTRACTION-4 у пациентов с местнораспространенным, неоперабельным или диссеминированным HER2 отрицательным РЖ, ранее не получавших терапии по поводу метастатического процесса, с ECOG статусом 0-1 изучалась целесообразность добавления ниволумаба к первой линии лечения SOX/CapeOX.
Пациенты были рандомизированы в соотношении 1:1 в группу (n=362) SOX/CapeOX в комбинации с ниволумабом 360 мг в/в кап. 1 раз в 3 недели или в группу (n=362) SOX/CapeOX с плацебо. Лечение продолжалось до прогрессирования или непереносимой токсичности. Пациенты были стратифицированы в соответствии со статусом ECOG, экспрессией PD-L1 на клетках опухоли, распространенностью болезни и страной проживания.
Первичными конечными точками исследования были медиана выживаемости без прогрессирования (МВБП), оцененная независимым центральным комитетом, и медиана общей выживаемости (МОВ). МВБП, оцененная исследователями, частота объективного ответа (ЧОО), КРО, время до достижения ответа и безопасность терапии являлись вторичными конечными точками.
Статус PD-L1 определялся в образцах опухолей у всех пациентов с использованием иммуногистохимического набора 28-8 pharmDx.
У большинства пациентов, включенных в исследование, был впервые выявленный ДРЖ (77,3-77,1%), диффузный подтип опухоли (53,0-48,6%), число пораженных органов более 2 (70,2-71,0%) и экспрессия PD-L1 <1 (84,0-84,5%).
При медиане наблюдения в 11,6 мес. в исследовании было продемонстрировано статистически значимое увеличение МВБП без увеличения МОВ.
МВБП в группе ХТ с ниволумабом достигла 10,45 мес., в контрольной группе – 8,34 мес. (HR=0,68; 95% ДИ 0,51-0,90; p=0,0007), при 12-месячной ВБП в 45,4% и 30,6% соответственно (рис.1). Таким образом, добавление ниволумаба позволило снизить риск прогрессирования болезни на 32%.
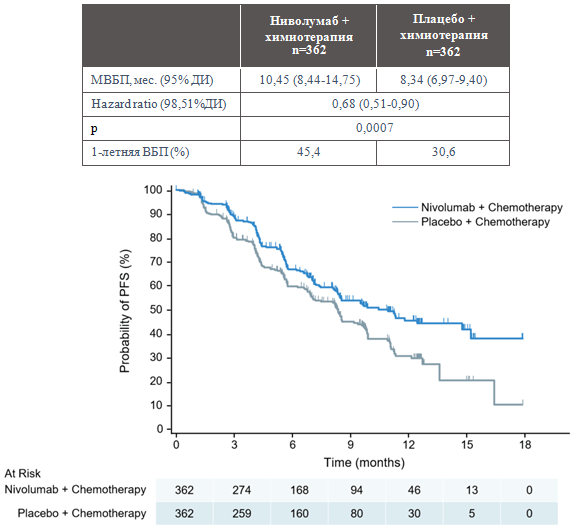
Рисунок 1. График выживаемости без прогрессирования болезни в лечебных группах.
МОВ в группе ХТ в комбинации ниволумабом составила 17,45 мес. и 17,15 мес. с плацебо (HR=0,90; 95% ДИ 0,75-1,08; p=0,257) (рис.2).
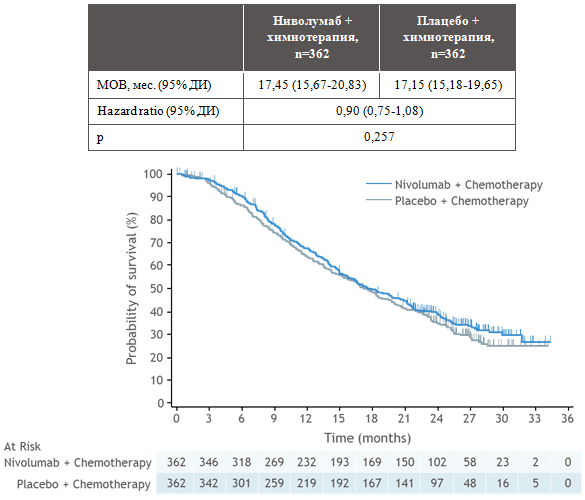
Рисунок 2
ОО в группе ХТ с ниволумабом зарегистрирован у 57,5% пациентов, в группе с плацебо – у 47,8% (p=0,0088), при равной медиане времени до достижения ответа в 1,4 мес. Особый интерес представляет медиана длительности ответа, достигнутого на терапии; так, в группе ХТ с ниволумабом она составила 12,91 мес. против 8,67 мес. в группе с плацебо.
Переносимость нового режима была приемлемой, добавление ниволумаба к химиотерапии несколько увеличило частоту нежелательных явлений (НЯ) 3 степени и выше с 64,8% до 71,4%, НЯ послужили причиной прекращения терапии у 7,3% и 10,6% пациентов соответственно. В группе ХТ в комбинации с ниволумабом чаще были зарегистрированы такие иммуноопосредованные НЯ ≥3 степени, как эндокринные нарушения (2,2%), сыпь (3,9%), пульмониты (1,1%) и инфузионные реакции (3,3%).
CheckMate 649
На ESMO 2020 г. были представлены результаты открытого рандомизированного исследования III фазы CheckMate 649, в котором больные местнораспространенным, нерезектабельным или диссеминированным РЖ в качестве первой линии лечения получали ниволумаб в комбинации с ипилимумабом или химиотерапию (FOLFOX6/XELOX) в комбинации с ниволумабом или только химиотерапию. Пациенты были рандомизированы в группы в соотношении 1:1:1 и стратифицированы в соответствии с уровнем экспрессии PD-L1 на опухолевых клетках, страной проживания, статусом ECOG и режимом химиотерапии (XELOX или FOLFOX). В настоящий момент доступны результаты второй и третьей групп.
Исследование обладало сложным иерархический дизайном, первоначально было необходимо доказать, что добавление ниволумаба к химиотерапии позволяет значимо увеличить МОВ в группе с CPS ≥5, далее с CPS ≥1 и потом уже у всех пациентов. Соответственно, первичными конечными точками исследования были МОВ и МВБП у пациентов при CPS ≥5, а ЧОО, МОВ и МВБП (CPS ≥1, CPS ≥10 и во всей группе) являлись вторичными конечными точками.
Статус PD-L1 определялся в образцах опухолей у всех пациентов с использованием иммуногистохимического набора 28-8 pharmDx.
При медиане наблюдения в 12,1 мес. у пациентов с CPS >5 МОВ в группе ХТ с ниволумабом (n=473) составила 14,1 мес. против 11,1 мес. в группе только химиотерапии (n=482) (HR=0,71; 95% ДИ 0,59-0,86; p<0,0001) (рис.3). Таким образом, добавление ниволумаба к стандартной химиотерапии позволило снизить риск смерти на 29% и увеличить МОВ на 3,3 мес.
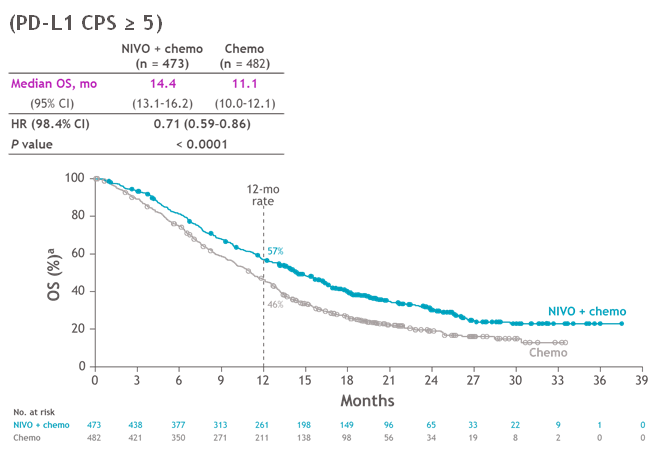
Рисунок 3
Комбинация ниволумаба с химиотерапией (XELOX или FOLFOX) позволила статистически значимо увеличить МОВ как у пациентов с CPS >1 с 11,3 мес. до 14,0 мес. (HR=0,77; 95% ДИ 0,64-0,92; p=0,0001), так и в общей группе – с 11,6 мес. до 13,8 мес. (HR=0,80; 95% ДИ 0,68-0,94; p=0,0002).
Добавление ниволумаба к химиотерапии продемонстрировало значимое увеличение МВБП во всех подгруппах: при CPS >1 c 6,9 мес. до 7,5 мес. (HR=0,74; 95% ДИ 0,65-0,85), при CPS >5 с 6,0 мес. до 7,7 мес. (HR=0,68; 95% ДИ 0,56-0,81; p<0,0001) и в общей группе с 6,9 мес. до 7,7 мес. (HR=0,77; 95% ДИ 0,68-0,87).
В подгруппе пациентов с CPS >5 комбинация ниволумаба и ХТ позволила достигнуть ЧОО в 60% (ПО – 12% и ЧО – 48%) против 45% (ПО – 7 % и ЧО – 38%) в группе только химиотерапии (p<0,0001). Медианы времени до достижения ответа в группах были равными и составили 1,5 мес. Медиана длительности ответа в группе с ниволумабом (n=226) – 9,5 мес. против 7,0 мес. в контрольной группе (n=177).
НЯ ≥3 степени были зарегистрированы у 59% больных (n=462) в группе с ниволумабом и у 44% в контрольной группе, НЯ послужили причиной завершения терапии в 17% (n=131) и 9% (n=67) случаев соответственно. Наиболее частыми нежелательными явлениями, зарегистрированными у ≥20% пациентов, получавших комбинацию ниволумаба с химиотерапией, были полинейропатия, тошнота, слабость, диарея, рвота, снижение аппетита, боли в животе, запор и боли в мышцах. Иммуноопосредованные НЯ ≥3 степени были представлены эндокринными нарушениями (<1%), пульмонитами (2%) и гепатитами (4%). От НЯ, связанных с лечением, погибло 12 пациентов в группе с ниволумабом и 4 пациента в контрольной группе.
| Исследование | ATTRACTION-4 | CheckMate 649 | ||
| Регион | Япония, Корея, Тайвань | Страны Азии, США, Канада | ||
| Режимы химиотерапии | SOX/CapeOX | SOX/CapeOX + ниволумаб |
XELOX/FOLFOX | XELOX/FOLFOX + ниволумаб |
| Число пациентов | 362 | 362 | 792 | 789 |
| МВБП, мес. HR (95% ДИ), p |
8,34 | 10,45 | 6,9 | 7,7 |
| 0,68 (0,51-0,90), p=0,0007 | 0,77 (0,68-0,87), p=НД | |||
| МВБП, мес. CPS ≥1 HR (95% ДИ) |
4,37 | 8,34 | 6,9 | 7,5 |
| 0,8 (НД) | 0,74 (0,65-0,85) | |||
| МВБП, мес. CPS ≥5 HR (95% ДИ) |
НД | 6,0 | 7,7 | |
| 0,68 (0,56-0,81), p<0,0001 | ||||
| МОВ, мес. HR (95% ДИ), p |
17,15 | 17,45 | 11,6 | 13,8 |
| 0,90 (0,75-1,08), p=0,257 | 0,80(0,68-0,94), p=0,0002 | |||
| МОВ, мес. CPS ≥1 HR (95% ДИ) |
16,62 | 16,56 | 11,3 | 14,0 |
| 1,06 (НД) | 0,77 (0,64-0,92), p=0,0001 | |||
| МОВ, мес. CPS ≥5 HR (95% ДИ) |
11,1 | 14,4 | ||
| 0,71 (0,59-0,86), p<0,0001 | ||||
На основании данных, представленных в исследованиях, рекомендуется два дозовых режима ниволумаба:
Источники: