12.04.2021
Рецептор Trop-2 (TACSTD2), как и рецептор EpCAM (TACSTD1), входит в семейство рецепторов TACSTD и в норме экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции пролиферации, клеточной адгезии и миграции. Гиперэкспрессия рецептора Trop-2 выявляется при многих солидных опухолях и в большинстве случаев ассоциируется с неблагоприятным прогнозом.
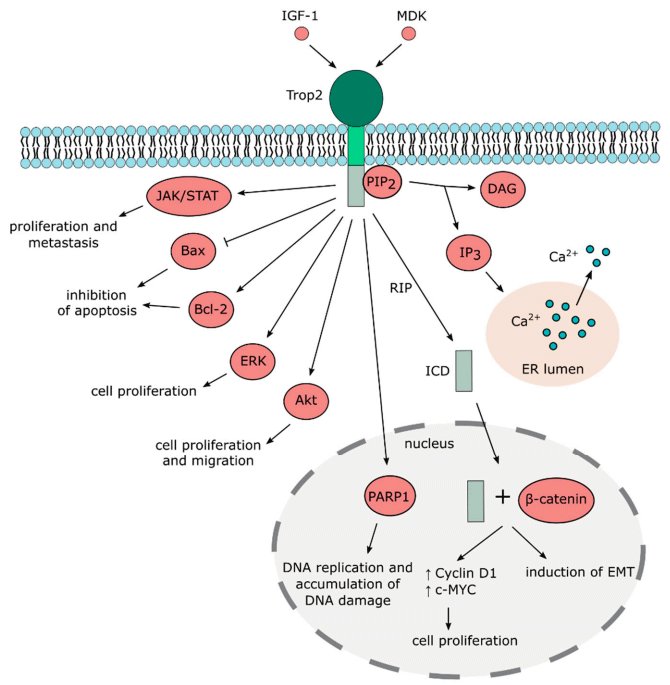
Рисунок 1. Сигнальные пути рецептора Trop-2.
Сацитузумаб говитекан (Trodelvy, IMMU-132, SG) представляет собой конъюгат, состоящий из моноклонального антитела против трансмембранного рецептора Trop 2 (trophoblast cell-surface antigen 2) и активного метаболита иринотекана, ингибитора топоизомеразы I – говитекана (SN-38).
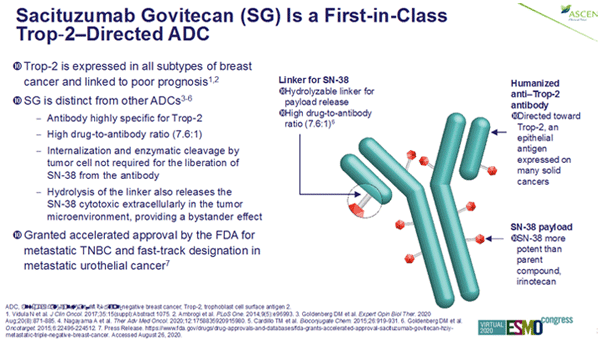
Рисунок 2. Строение сацитузумаба говитекана.
В апреле 2020 г. на основании результатов исследования 1/2 фазы IMMU-132-01 сацитузумаб говитекан получил ускоренное одобрение FDA для лечения больных диссеминированным ТНРМЖ, ранее получивших не менее 2 линий терапии по поводу метастатической болезни. В IMMU-132-01 при медиане наблюдения в 9,7 мес. применение SG при ТНРМЖ (n=108) позволило достигнуть медианы выживаемости без прогрессирования (МВБП) в 5,5 мес., медианы общей выживаемости (МОВ) в 12,7 мес. при частоте объективного ответа (ЧОО) в 31%. В исследовании было показано, что уровень экспрессии Trop-2 не коррелирует с эффективностью терапии.
7 апреля 2021 г. на основании данных, полученных в исследовании 3 фазы ASCENT, сацитузумаб говитекан получил постоянное одобрение FDA для больных местнораспространенным или метастатическим ТНРМЖ, ранее получивших две и более линии химиотерапии, но как минимум одну по поводу диссеминированного процесса.
Исследование ASCENT (NCT02574455)
В исследование ASCENT было включено 489 больных ТНРМЖ, которые ранее получили как минимум две линии химиотерапии, одну из которых по поводу метастатической болезни.
Пациенты были рандомизированы в две группы в соотношении 1:1: первая группа (n=267) получала сацитузумаб говитекан в одобренном ранее режиме 10 мг/кг в 1 и 8 дни каждого 21 дневного цикла, вторая (n=262) – терапию по выбору врача (ТВВ) – эрибулин, капецитабин, винорельбин или гемцитабин. Лечение проводилось до прогрессирования или непереносимой токсичности.
Первичной конечной точкой исследования была выживаемость без прогрессирования болезни, оцененная независимым центральным комитетом, вторичными – общая выживаемость, частота достижения объективного ответа, контроля роста и безопасность терапии.
Средний возраст пациентов в исследовании составил 53-54 года, 60% участников имели статус ECOG 1, а ТНРМЖ впервые был установлен у 70% (выявлено изменение суррогатного молекулярно-биологического подтипа опухоли после предшествующего лечения).
Стратификацию проводили с учетом количества предшествующих линий химиотерапии, наличия метастазов в головном мозге и географического региона.
МВБП и МОВ были достоверно выше в группе сацитузумаба говитекана в сравнении с когортой ТВВ и достигли 5,6 мес. против 1,7 мес. (p<0,001) и 12,1 мес. против 6, 7 мес. (p<0,001) соответственно, что позволило снизить риск прогрессирования болезни на 59%, а риск смерти – на 52%. Подгрупповой анализ продемонстрировал преимущество сацитузумаба говитекан во всех когортах больных.
Токсичность сацитузумаба говитекана была несколько выше; так, нейтропения ≥3 в группе сацитузумаба говитекана наблюдалась у 51% больных против 33% в группе ТВВ, анемия – у 8% и 5%, диарея – у 10% и <1% и фебрильная нейтропения зарегистрирована у 6% и 2% пациентов соответственно. Частота редукции доз в группах была сопоставима и составила 22% (сацитузумаб говитекан) и 26% (ТВВ). В группе сацитузумаба говитекана смертей, связанных с лечением, зарегистрировано не было, а в группе ТВВ один пациент погиб от сепсиса, развившегося на фоне фебрильной нейтропении. НЯ послужили причиной прекращения терапии в группе сацитузумаба говитекана в 4,7% и 5,4% случаях в группе ТВВ.
Таким образом, сацитузумаб говитекан – новый стандарт терапии больных метастатическим ТНРМЖ в поздних линиях лечения.
Источники: