12.10.2020

В этом году конгресс ESMO ознаменовался сразу 4 знаковыми исследованиями с иммунотерапией, изменяющими наши подходы в лечении рака пищевода и желудка.
Операбельный рак пищевода
Первое из них было посвящено адъювантной терапии больных операбельным раком пищевода. На сегодняшний момент пациентам с плоскоклеточным раком после хирургического лечения в объеме R0 в послеоперационном периоде проведение адъювантной терапии не рекомендуется. При аденокарциномах послеоперационная химиотерапия может быть проведена в двух ситуациях: как заключительная часть периоперационной терапии либо собственно адъювантно при локализации опухоли в пищеводно-желудочном переходе (по принципам лечения рака желудка).
В исследовании CHECKMATE-577 [1] пациенты с раком пищевода, получившие комплексное лечение (предоперационную химиолучевую терапию и хирургическое лечение) и у которых не был достигнут полный лечебный патоморфоз (pCR), рандомизировались в группу наблюдения или терапии ниволумабом в течение 1 года. Первичной задачей исследования было улучшение безрецидивной выживаемости (DFS). В исследовании приняли участие 794 пациента, в основном, из Европы, США и Канады, плоскоклеточный рак был у 29% больных. Иммунотерапия вдвое увеличила медиану DFS (c 11,0 до 22,4 мес.; HR 0,69; 95% ДИ 0,56-0,86), 2-летние результаты не были представлены, но, судя по графику, это вылилось в увеличение показателя с приблизительно 38% до 48% (рис.1.). Подгрупповой анализ показал схожий выигрыш как для аденокарцином, так и для плоскоклеточных раков, экспрессия PD-L1 на опухолевых клетках также не влияла на эффективность. Отмечено отсутствие улучшения DFS у пациентов с опухолью пищеводно-желудочного перехода (40% больных). Данные по общей выживаемости (OS) еще не представлены. Интересно, что терапия ниволумабом хорошо переносилась в столь тяжело предлеченной группе больных – частота осложнений не отличалась от группы с плацебо.
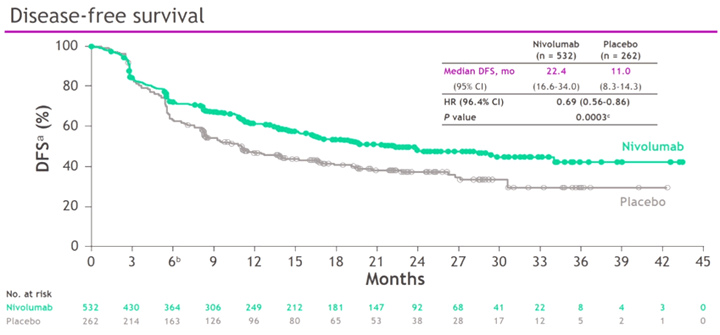
Рисунок 1. Исследование CHECKMATE-577, безрецидивная выживаемость.
Метастатический рак пищевода, первая линия
Не существует стандартной терапии первой линии метастатического рака пищевода. Аденокарциномы лечатся по принципам рака желудка, при плоскоклеточном раке она строится на трех препаратах – производных платины, фторпиримидинах и таксанах. Иммунотерапия – пембролизумаб и ниволумаб – применяется самостоятельно в качестве второй линии у пациентов с плоскоклеточным раком с гиперэкспрессией PD-L1 CPS ≥10% и TPS ≥1% соответственно. На ESMO2020 были доложены результаты исследования III фазы KEYNOTE-590, в котором пациенты в качестве первой линии терапии получали комбинацию цисплатина (80 мг/м2 день 1) и фторурацила (800 мг/м2 в сутки 120-часовая инфузия 1-5 дни) с пембролизумабом или плацебо [2]. Статистический анализ предполагал сложный иерархический дизайн, где на первом этапе планировалось показать выигрыш в выживаемости до прогрессирования (PFS) в группе плоскоклеточного рака (73% всех пациентов), ОS в группе плоскоклеточного рака с гиперэкспрессией PD-L1 (CPS ≥10) и уже далее на всей популяции пациентов.
Добавление пембролизумаба привело к значимому улучшению OS при плоскоклеточном раке с CPS ≥10, которая встречалась у 52% больных, повысив медиану ОS с 8,8 до 13,9 мес. (HR 0,57; 95% ДИ 0,43-0,75) (рис.2). Эффективность комбинации в остальных подгруппах пациентов в зависимости от морфологии и экспрессии PD-L1 в отношении PFS и OS была меньшей, детальные результаты не представлены. Также возросла и частота объективного ответа (ЧОО), составив в экспериментальной группе у всех больных 45% по сравнению с 29,3% при одной химиотерапии. Переносимость нового режима оказалась приемлемой, увеличив частоту осложнений 3-4 степени с 67,6% до 71,9%.
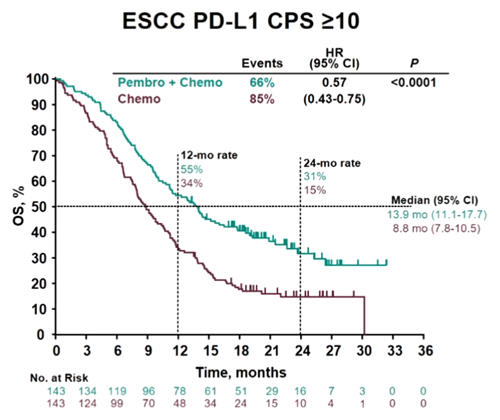
Рисунок 2. Исследование KEYNOTE-590, общая выживаемость.
Метастатический рак желудка
В лечении метастатического рака желудка иммунотерапия до последнего времени занимала скромное место в третьей и последующих линиях терапии – ниволумаб вне зависимости от экспрессии PD-L1, а пембролизумаб – при уровне экспрессии CPS ≥1. Попытки «прорыва» пембролизумаба и авелумаба во вторую и первую линии лечения не увенчались успехом. На ESMO2020 были представлены результаты сразу двух исследований – CHECKMATE-649 и ATTRACTION-4, в которых в качестве первой линии терапии изучалось добавление ниволумаба к химиотерапии.
В первом из них 1581 пациент был рандомизирован в группы химиотерапии (XELOX или FOLFOX), химиотерапии + ниволумаб [3]. Статистический анализ предполагал иерархический дизайн, где первоначально было необходимо показать улучшение ОВ в группе с CPS ≥5, далее с CPS ≥1 и потом уже на всех пациентах. Большинство больных было из не стран Азии, собственно рак желудка имел место у 70% пациентов, а у 18% и 13% была аденокарцинома пищеводно-желудочного перехода и пищевода соответственно. В группе химиоиммунотерапии у пациентов с CPS ≥5 (60% всех больных) удалось достичь значимого увеличения ОВ – медианы с 11,1 до 14,4 мес. (HR 0,71; 95% ДИ 0,59-0,86), 1-летняя ОS выросла с 46% до 57% (рис.3). Увеличилась и ЧОО – с 45% до 60%. Выигрыш в ОS отмечался и в подгруппе с CPS ≥1 и у всех пациентов, однако сделать вывод о реальной эффективности нового подхода в подгруппе пациентов с отсутствием или низкой экспрессией PD-L1 невозможно, так как не были представлены результаты поданализа в зависимости от уровня CPS. Добавление ниволумаба привело к закономерному росту токсичности – с 44% до 59% выросла частота осложнений 3-4 степени, а прекратили лечение вследствие токсичности 32% и 53% соответственно.
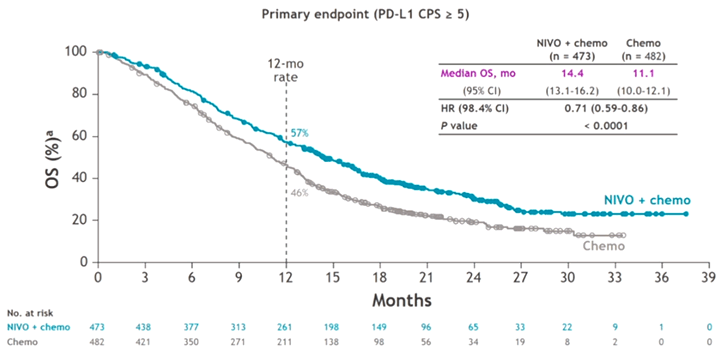
Рисунок 3. CHECKMATE-649, общая выживаемость (CPS ≥5).
В другом плацебо контролируемом исследовании ATTRACTION-4 участвовало 724 пациента из Японии, Южной Кореи и Тайваня [4]. В качестве первой линии больные рандомизировались в группу химиотерапии (режимы XELOX или SOX) или химиотерапии с добавлением ниволумаба. Статистическая гипотеза включала две основных задачи – улучшение PFS и OS. На ESMO2020 был представлен промежуточный анализ эффективности. Применение ниволумаба позволило достоверно увеличить медианы PFS с 8,3 до 10,5 мес. (HR 0,68; 95% ДИ 0,51-0,90) и ЧОО с 48% до 58%, различия в OS отсутствовали (HR 0,9). Переносимость экспериментального режима была приемлемой, частота нежелательных явлений возросла незначительно.
Несмотря на кажущиеся различия в результатах двух этих исследований, их прямое сравнение крайне затруднительно по ряду причин. Так, в отличие от CHECKMATE-649, в исследовании ATTRACTION-4 принимали участие только пациенты из Азии, экспрессия PD-L1 определялась только на опухолевых клетках, значительно большая часть пациентов получала химио- и иммунотерапию во последующих линиях.
Заключение
2020 год ознаменовался значимыми изменениями в подходах к иммунотерапии рака пищевода и желудка, которые сейчас выглядят следующим образом:
Данные изменения уже внесены в проекты обновленных рекомендаций RUSSCO и АОР.
Список литературы: