12.10.2020

На прошедшем в виртуальном формате конгрессе ESMO2020 были доложены долгожданные 5-летние результаты исследования KEYNOTE-024 [1], целью которого было оценить эффективность и токсичность пембролизумаба в сравнении с химиотерапией в качестве первой линии у больных НМРЛ с экспрессией PD-L1 на мембране 50% и более опухолевых клеток. Больные были рандомизированы в группу пембролизумаба, который назначали в/в в дозе 200 мг каждые 3 недели в течение 2 лет или прекращали ранее при признаках прогрессирования или токсичности или химиотерапию по выбору врача. Разрешалось использовать комбинации карбоплатин-гемцитабин, цисплатин-гемцитабин, карбоплатин-паклитаксел каждые 3 недели 4-6 курсов. Для больных с аденокарциномой разрешалось назначать карбоплатин или цисплатин в сочетании с пеметрекседом каждые 3 недели 4-6 курсов с последующей поддержкой пеметрекседом до признаков прогрессирования или токсичности. Больные в группе химиотерапии в случае прогрессирования заболевания могли получать пембролизумаб в качестве терапии второй линии. Основным критерием эффективности была медиана времени до прогрессирования, в качестве дополнительных критериев оценивали общую продолжительность жизни, частоту объективного эффекта и его продолжительность, токсичность проводимой терапии.
Первые результаты этого исследования продемонстрировали явное преимущество пембролизумаба перед химиотерапией независимо от морфологии опухоли [2]. Препарат был разрешен к использованию в качестве монотерапии у больных с метастатическим НМРЛ с высокой экспрессией PD-L1 в качестве первой линии. Интригой оставалась способность пембролизумаба, и вообще иммунотерапии как лечебного подхода, приводить к излечению от этого страшного заболевания. И вот были доложены 5-летние результаты этого исследования. Пембролизумаб продолжает демонстрировать свое преимущество по показателям общей выживаемости, несмотря на то, что 66% больных в группе химиотерапии получали пембролизумаб или другие ингибиторы PD-1/PD-L1 при прогрессировании заболевания: 5-летняя общая выживаемость составила 31,9% в группе пембролизумаба и 16,3% в группе химиотерапии, что соответствует достоверному снижению относительного риска смерти на 38%.
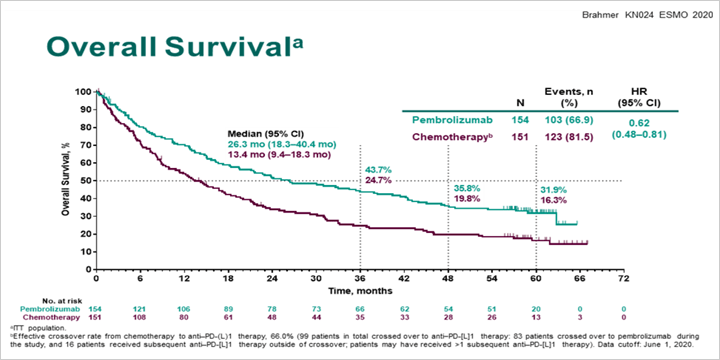
Получение иммунотерапевтических препаратов при прогрессировании существенно удлинили продолжительность жизни больных в группе химиотерапии в сравнении с историческим данными, которые демонстрировали 5-общую выживаемость на уровне 1-2%. В группе пембролизумаба 35 больных получили пембролизумаб запланированные 2 года, из них 81% живы при сроке наблюдения 5 лет и 46% живут без признаков прогрессирования заболевания. При более длительном наблюдении не получено новых сигналов об отдаленной токсичности использования пембролизумаба.
Таким образом, исследование KEYNOTE-024 убедительно свидетельствует о преимуществе пембролизумаба перед химиотерапией в первой линии у больных с высокой экспрессией PD-L1: 5 лет и более живут 31,9% пациентов, что драматическим образом отличается от исторических данных по использованию химиотерапии при метастатическом НМРЛ. Вместе с тем примерно 30% в группе пембролизумаба погибали от прогрессирования болезни в течение года от начала лечения. Также, в отличие от результатов иммунотерапии метастатической меланомы, при которой среди живущих больных после 3 лет наблюдения отмечается низкая частота фатальных исходов, примерно у 12% больных раком легкого отмечен летальный исход после этой даты и кривые продолжительности жизни стремятся вниз, не демонстрируя достижения плато. Хотелось бы надеяться, что большинство больных, достигших 5-летнего срока наблюдения, будут считаться излеченными, что может быть подтверждено лишь дальнейшим наблюдением.
Остается открытым вопрос о возможности улучшения результатов лечения в подгруппе больных с высокой экспрессией от совместного применения химиотерапии и пембролизумаба. Поэтому мы ждем результатов исследования KEYNOTE-189 по совместному применению химиотерапии и пембролизумаба в сравнении с химиотерапией у больных метастатическим НМРЛ в первой линии [3]. Сегодня известно, что в подгруппе больных с высокой экспрессией PD-L1 (более 50% опухолевых клеток) медиана общей выживаемости составила 27,7 мес. в группе комбинации против 10,1 мес. в группе химиотерапии, что соответствует снижению относительного риска смерти на 41%. И медиана продолжительности жизни, и снижение риска смерти в группах больных с иммунотерапией в обоих исследованиях очень близки, что оправдывает назначение только пембролизумаба в монотерапии у больных с высокой экспрессией PD-L1. Однако сохраняется надежда, что комбинация химиотерапии и иммунотерапии сможет увеличить показатель 5-летней общей выживаемости с выведением кривой на плато.
Еще одним заметным событием этого года было объявление предварительных результатов исследования ADAURA по изучению эффективности осимертиниба в качестве адъювантной терапии у больных IB-IIIA НМРЛ с наличием активирующей мутации гена EGFR [4]. Осимертиниб является представителем третьего поколения ингибиторов тирозинкиназы, способным блокировать активность EGFR как в случае появления активирующей мутации в 19 и 21 экзоне, так и при возникновении мутации резистентности к ингибиторам первого-второго поколения T790M. Препарат зарегистрирован для проведения первой линии системной терапии метастатического НМРЛ при наличии активирующей мутации гена EGFR, а также при прогрессировании на фоне лечения ингибиторами первого-второго поколения в случае возникновения мутации Е790M.
ADAURA – это рандомизированное двойное слепое исследование, в котором сравнивали эффективность осимертиниба и наблюдения за больными НМРЛ IB-IIIА стадиями НМРЛ с активирующими мутациями (ex19del или L858R) после радикальной операции и окончания адъювантной химиотерапии, если она проводилась. Рандомизация проводилась с учетом стратификационных факторов: стадия (IA vs II vs IIIA), мутация (ex19del vs L858R) и раса (европеоидная или азиатская). Больные в группе осимертиниба принимали 80 мг внутрь ежедневно в течение 3 лет. Первичной конечной точкой была безрецидивная выживаемость в группе больных II-IIIA стадий, вторичными были безрецидивная и общая выживаемость для всех включенных больных, токсичность и качество жизни. Исследование было расслеплено решением независимого комитета, мониторирующего исследование, в связи с высокой эффективностью в группе осимертиниба. На момент расслепления все запланированные больные были включены в исследование и прослежены не менее 1 года от момента рандомизации.
В исследование было включено 682 больных с медианой возраста 63 года, преимущественно женщин (70%), азиатов (64%), с распределением по стадиям IB – 31%, II – 34%, IIIA – 35%, из которых 56% получали адъювантную химиотерапию с включением цисплатина. Медиана времени до прогрессирования больных II-IIIA стадий составила 20,4 мес. в группе наблюдения и не достигнута в группе осимертиниба, 3-летняя безрецидивная выживаемость составила 28% и 80% соответственно, что соответствует достоверному снижению относительного риска прогрессирования на 83% (HR=0,17; p<0,0001). Показатель 3-летней безрецидивной выживаемости для всех больных составил 79% и 41% соответственно со снижением относительного риска прогрессирования на 79% (HR=0,21; p<0,0001). Выигрыш от назначения осимертиниба наблюдался во всех анализируемых подгруппах и не зависел от предшествующего проведения адъювантной химиотерапии и стадии. Снижение относительного риска прогрессирования при IB стадии составило 50%, при II – 83%, IIIA – 88%. Данные по общей выживаемости не могут быть представлены, так как на момент анализа умер 1 пациент в группе осимертиниба и 3 в группе наблюдения.
На конгрессе ESMO2020 был представлен анализ влияния осимертиниба на частоту метастазирования в ЦНС. Метастазирование в головной мозг является частым проявлением прогрессирования у больных НМРЛ после выполнения радикальной операции, плохо поддается локальной и системной терапии и часто является причиной смерти. В исследовании RADIANT по изучению эффективности адъювантной терапии метастазы в головной мозг были диагностированы у 37% больных [5]. В исследовании FLAURA прием осимертиниба сочетался со снижением риска прогрессирования в ЦНС на 52% в сравнении с гефитинибом или эрлотинибом у больных с метастатическим НМРЛ. В исследовании ADAURA метастазирование в ЦНС зарегистрировано у 39 (11%) больных в группе наблюдения у 6 (2%) в группе осимертиниба, из них умерли по этой причине 6 (2%) и 2 (1%) пациента соответственно [6]. Показатель 3-летней выживаемости без прогрессирования в ЦНС составил 98% для осимертиниба и 82% для наблюдения, что соответствует достоверному снижению риска прогрессирования в ЦНС на 82% (HR=0,18; p<0,0001). Снижение частоты метастазирования в ЦНС теоретически должно сказаться на улучшении показателей общей выживаемости в группе осимертиниба.
Достижение запланированного показателя по безрецидивной выживаемости было причиной расслепления больных в исследовании ADAURA, в связи с чем мы, вероятно, не получим сравнительные данные по общей выживаемости. Более длительное наблюдение позволит получить показатель 5-летней общей выживаемости в группе осимертиниба и оценить, что происходит с больными после отмены приема препарата. Целью адъювантной терапии является излечение пациента. Опыт использования таргетной терапии показал способность ингибиторов тирозинкиназы рецептора EGFR увеличивать продолжительность жизни больных метастатическим НМРЛ, но не приводит к их излечению. Вопрос, будет ли способен осимертиниб излечивать НМРЛ на ранних стадиях или только отодвигать наступление прогрессирования, ожидает своего ответа при дальнейшем наблюдении за больными. Но уже сегодня столь большой и длительный выигрыш в безрецидивной выживаемости может служить основанием рекомендовать осимертиниб в качестве адъювантной терапии у больных НМРЛ IB-IIIA стадиями c мутацией гена EGFR после выполнения радикальной операции.
У больных НМРЛ с транслокацией ALK в связи с появлением ингибиторов второго-третьего поколения происходит смена стандартов терапии. Лорлатениб – ингибитор ALK третьего поколения, обладающий высокой селективностью к различным вариантам транслокации ALK, а также к мутациям в киназном домене, возникающим при лечении ингибиторами первого-второго поколений. В рандомизированном исследовании CROWN лорлатениб в дозе 100 мг внутрь ежедневно сравнивали с ингибитором первого поколения кризотинибом в дозе 250 мг 2 раза в день ежедневно в качестве первой линии системной терапии у больных с метастатическим НМРЛ с транслокацией ALK. Разрешалось включать больных с метастазами в головной мозг, не требующих терапии или после проведения локальной терапии. Основным критерием эффективности была медиана времени до прогрессирования. На ESMO2020 были доложены предварительные результаты исследования, в которое был включен 291 больной [7]. При медиане наблюдения 18 мес. медиана времени до прогрессирования составила 9,3 мес. в группе кризотиниба и не была достигнута в группе лорлатениба, одногодичная выживаемость без прогрессирования составила 39% и 78%, что соответствует достоверному снижению относительного риска прогрессирования на 72% (HR=0,28; p<0,001). Объективный эффект был зарегистрирован у 58% и 76% больных соответственно. Метастазы в головной мозг диагностированы у 27% больных в группе кризотиниба и у 26% в группе лорлатениба, частота объективного ответа интракраниальных метастазов составила 23% и 82% соответственно. Осложнения 3-4 степени были зарегистрированы у 27% и 34% больных. Лечение лорлатенибом сопровождалось необычными для ALK ингибиторов побочными эффектами, в основном легкой степени: гиперхолистеринэмия, гипергицеридэмия, увеличение веса, периферическая нейропатия, снижение памяти. Авторы делают предварительный вывод о высокой эффективности ингибитора ALK третьего поколения лорлатениба при проведении первой линии системной терапии. Этот препарат, наряду с алектинибом, бригатинибом и энсартинибом, пополняет арсенал ALK ингибиторов и претендует на первенство в первой линии, заменив прежний стандарт лечения кризотинибом.
Ключевые слова: немелкоклеточный рак легкого, адъювантная терапия, первая линия, химиотерапия, таргетная терапия мутация EGFR,пембролизумаб, PD-L1, осимертиниб.
Литература: