08.06.2020

Несмотря на пандемию коронавируса и необычный формат проведения съезда, последний оказался богатым на события как для рака ободочной, так и для рака прямой кишки. Важными и интересными были сообщения о новых исследованиях, обновленных данных по уже проведенным программам, а также по новым лекарственным препаратам.
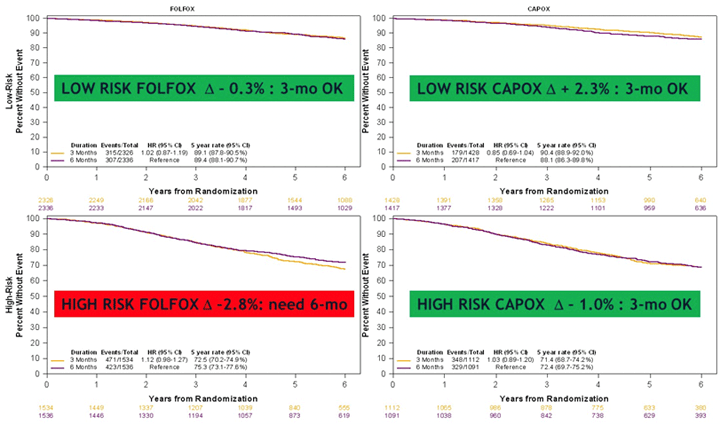
В этом году не обошли стороной сообщения по лечению местнораспространенных форм опухоли ободочной и прямой кишки. Первым, довольно значимым событием явилось представление данных исследования IDEA. В связи с тем, что при изучении в 2018 г. результатов 6 исследовании адъювантной терапии рака ободочной кишки (TOSCA, SCOT, IDEA FRANCE, ACHIENE, HORG, CALGB/SWOG80702) не было получено статистически достоверных данных, указывающих на то, что терапия в течение 3 месяцев не уступает по общей выживаемости лечению в течение 6 месяцев [1]. Было проведено обновление данных для вторичной цели – изучения общей выживаемости (ОВ) [2]. Также проведен апдейт результатов по беспрогрессивной выживаемости (БПВ) с медианой наблюдения 6 лет, кроме того, выполнен подгрупповой анализ по этим показателям. Всего анализу подверглись 12 835 пациентов. Установлена статистически достоверная разница в снижении частоты 3-4 ст. периферической нейропатии с 16% при использовании режима FOLFOX в течение 6 месяцев до 3% при использовании САРОХ в течение 3 мес. Не выявлено разницы в 5-летней ОВ: при 3 мес. терапии она составила 82,4% против 82,8% при проведении лечения в течение 6 месяцев (HR=1,02; р=0,0583). Были подведены итоги:
Прозвучали следующие выводы: 60% пациентов с III стадией рака ободочной кишки имеют низкий риск развития рецидива и им следует проводить 3 месяца CAPOX. 40% больных имеют высокий риск, большинству из них следует предложить все тот же CAPOX 3 месяца. Для тех, кто не желает терять 1-2% в эффективности, можно рекомендовать лечение в течение 6 месяцев.
Другим интересным исследованием было изучение целекоксиба в качестве дополнительного препарата к режиму FOLFOX, используемому в адъювантной терапии больных c III ст. рака ободочной кишки (результаты исследования CALGB/SWOG80702) [3]. Несмотря на то, что было получено незначительное улучшение 5-летней выживаемости на 0,9% при проведении лечения в течение 3 месяцев и на 3,5% – в течение 6 месяцев, разница оказалась статистически недостоверной (р=0,5252). Авторы планируют продолжить исследования архивных блоков с целью попытки установления молекулярно-биологических предикторов ответа на лечение.
Изучению роли неоадъювантной химиотерапии FOLFOX с или без панитумумаба у больных с местнораспространенным раком ободочной кишки было посвящено исследование FOxTROT [4]. 1053 пациента со стадией T3-4, N0-2, M0 были рандомизированы в первую группу, с 6 неделями оксалиплатин-фторпиримидин неоадъювантной и 18 неделями послеоперационной адъювантной химиотерапии, или во вторую группу, с 24 неделями только адъювантной химиотерапии. Дополнительно 279 пациентов с RAS(wt) рандомизированы на группы с или без панитумумаба в неоадъювантной химиотерапии. Преимущество в уменьшении рецидивов болезни, опухолевой регрессии наблюдалось у пациентов с Т4 опухолью, локализацией в левой половине ободочной кишки, и у больных с pMMR опухолью. Не отмечались противоопухолевые ответы у пациентов с dMMR.
Традиционно много работ было посвящено лечению метастатического колоректального рака. Среди большого многообразия работ можно выделить следующие.
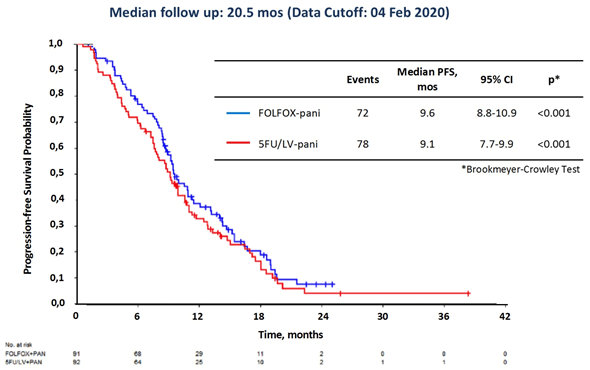
Исследование II фазы PANDA [5] попыталось изучить возможность деэскалации интенсивности терапии у ранее нелеченных больных старше 70 лет с диким типом RAS/BRAF метастатического колоректального рака. В одной группе пациенты получали FOLFOX с панитумумабом, в другой – FU/LV с панитумумабом. Химиотерапия проводилась в среднем в течение 6 месяцев, в дальнейшем осуществлялась поддерживающая терапия панитумумабом. Медиана ВБП составила 9,6 мес. для FOLFOX и 9,1 мес. для FU/LV. Частота общего ответа и продолжительность ответа была схожей в обеих группах при меньшей токсичности FU/LV с панитумумабом. Этот режим был выбран в качестве приемлемой опции для III фазы исследования.
Весьма интересным событием, имеющим большой практический интерес, явилась II-III фаза рандомизированного клинического исследования сравнительного анализа эффективности гепатэктомии в сравнении с гепатэктомией и последующим проведением mFOLFOX6, проведенного в Японии [6]. Существующие рекомендации применения FOLFOX после резекции метастазов печени основываются в основном на экстраполяции результатов исследования группы EORTC 40983 [6]. В японском исследовании ранее нелеченным пациентам выполнялась резекция печени, в дальнейшем одна группа больных (n=151) получала 12 циклов mFOLFOX6, в другой (n=149) проводилось динамическое наблюдение. Результаты оказались довольно неожиданными. Подгруппа больных, кому проводилась химиотерапия, имела лучшие результаты 5-летней ВБП в сравнении с только хирургическим лечением: 49,8% и 38,7% соответственно. Тогда как анализ ОВ дал противоположные результаты: 5-летняя ОВ в группе с химиотерапией составила 71,2% против 83,1% при изолированном хирургическом лечении. Пациенты с адъювантной химиотерапией в исследовании имели большую частоту изолированных метастазов в легкие, экстрапеченочные и экстрапульмонарные очаги болезни в сравнении с группой больных, получивших только хирургическое лечение. Были выдвинуты предположения, объясняющие более низкую ОВ в группе больных с химиотерапией: низкая комплаентность и более высокая частота нежелательных явлений, ограниченная возможность использования оксалиплатина при возникновении рецидива опухоли. Сделан вывод об отсутствии необходимости проведения адъювантной химиотерапии у пациентов после резекции печени.
Важным событием на ASCO 2020 явилось представление результатов рандомизированного исследования III фазы KEYNOTE-177 [7], где в первой линии лечения пациентов метастатическим колоректальным раком с MSI-H/dMMR монотерапия пембролизумабом сравнивалась со стандартной химиотерапией. Результаты этого исследования показали превосходство пембролизумаба в увеличении времени выживаемости без прогрессии: 16,5 мес. в сравнении с 8,2 мес. при проведении химиотерапии (р=0,0002). Ответ опухоли на лечение составил 43,8% на терапии пемброизумабом и 33,1% на химиотерапии.
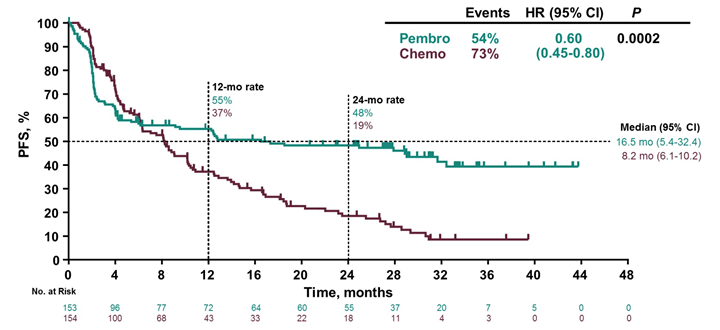
Таким образом, пембролизумаб становится новым стандартом лечения в первой линии терапии у пациентов с MSI-H метастатическим колоректальным раком.
Другое исследование оценивало безопасность и эффективность комбинации регорафениба и авелумаба у пациентов после ≥1 линии системной терапии метастатического колоректального рака без MSI-H [8]. Из 40 пациентов 28% имели уменьшение размеров опухоли, 53,5% – стабилизацию опухолевого процесса. Медиана ВБП составила 3,6 мес., ОВ – 10,8 мес., что является более значимыми результатами в сравнении с группой исторического контроля. Длительные ответы наблюдались у больных с увеличенной инфильтрацией опухоли CD8+ к 1 дню 2-го цикла.
Еще одним лекарственным препаратом пополнился арсенал лечебных средств, используемых при лечении рефрактерных пациентов с метастатическим колоректальным раком, имеющих IHC 3+, IHC 2+/ISH+. Препарат трастузумаб дерукстекан (T-DXd), представляющий из себя конъюгат лекарственного противоопухолевого препарата ингибитора топоизомеразы I и гуманизированного анти-Her2 моноклонального антитела, продемонстрировал высокую эффективность в исследовании DESTINY-CRC01 [9]. Использование T-DXd в дозе 6,4 мг/кг 1 раз в 21 день у пациентов, рефрактерных к стандартной терапии, позволило получить 45,3% общего противоопухолевого ответа на лечение и медиану выживаемости до прогрессии 6,9 мес. Интересно, что 30,2% больных уже ранее, до начала исследования, получали анти-Her2 терапию, тем не менее, у большинства из них была получена резорбция опухоли.
Долгожданным событием в лечении пациентов с метастатическим колоректальным раком можно считать появление нового лекарственного препарата AMG 510 – малой молекулы необратимого ингибитора KRASG12C [10]. В исследование включались пациенты, ранее получавшие лекарственную терапию. Объективный противоопухолевый эффект составил 12%, контроль болезни – 80%. Нежелательные явления наблюдались у 47,6%.
В этом году были представлены предварительные результаты исследования OPRA из MSKCC (США) [11]: применение органосохраняющего подхода у ранее нелеченных пациентов II/III ст. рака прямой кишки. После включения в исследование 324 пациента рандомизировались на 2 группы. Первая группа получала на первом этапе химиолучевое лечение (ХЛТ) → 2 цикла химиотерапии FOLFOX/CAPEOX 4 месяца, второй группе начинали лечение с FOLFOX/CAPEOX 4 месяца → ХЛТ. Лучевую терапию СОД = 50 Гр сочетали с приемом капецитабина 825 мг/м2 или непрерывной инфузией ФУ 225 мг/м2/день. В дальнейшем проводилось рестадирование с помощью эндоскопического обследования с биопсией и МРТ. В случае отсутствия полной резорбции пациентам выполняли хирургическое лечение, при наличии полной ремиссии проводилось тщательное динамическое наблюдение. Дополнительно проводилось сравнение больных с историческим контролем (ХЛТ → хирургическое лечение → ХТ). При медиане наблюдения 2,26 года не было получено различий в ВБП и выживаемости свободной от отдаленных метастазов в группах сравнения. Однако отмечено увеличение количества больных без последующего хирургического лечения в группе, где проводилось (ХЛТ) → 2 цикла химиотерапии (р=0,007). Не было получено разницы в историческом контроле в сравнении с группой пациентов без хирургического лечения.
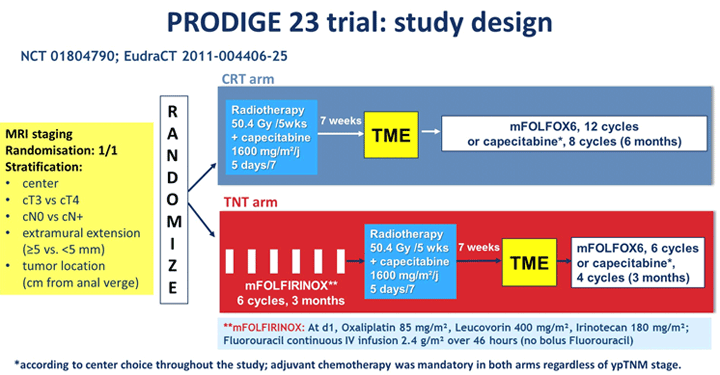
Еще одна работа, в которой объектом исследования были пациенты с раком прямой кишки, – исследование III фазы PRODIGE 23 [12]. Целью исследования было сравнение эффективности неоадъювантной терапии с mFOLFIRINOX и предоперационного курса ХЛТ у больных местнораспространенным раком прямой кишки. Часть больных получала ХЛТ в дозе 50,4 Гр в сочетании с приемом капецитабина 1600 мг в сутки → тотальная мезоректумэктомия (ТМЭ) → 12 циклов mFOLFOX6. Другая часть пациентов начинала лечение с проведения 6 циклов mFOLFIRINOX (без болюсного введения ФУ) → ХЛТ → ТМЭ → 6 циклов mFOLFIRINOX.
Частота полных патоморфологических ответов (ypT0N0) была выше в группе с неоадъювантной химиотерапией mFOLFIRINOX – 27,8% в сравнении с ХЛТ – 12,1% (р0,001). 3-летняя ВБП и 3-летняя выживаемость, свободная от отдаленных метастазов, также были достоверно выше в группе с неоадъювантной химиотерапией в сравнении с ХЛТ – 75,7% и 68,5%, 78,8% и 71,7% соответственно.
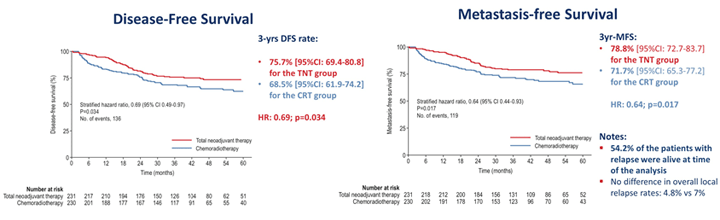
Авторами предложено рассматривать неоадъювантную терапию mFOLFIRINOX в качестве новой опции в лечении пациентов с Т3-Т4 ректальным раком.
Рандомизированное исследование III фазы RAPIDO попыталось ответить на вопрос, как можно уменьшить частоту появления отдаленных метастазов без увеличения локальных рецидивов у пациентов с местнораспространенным раком прямой кишки с высоким риском (T4a/b, N2) [13]. Пациентам в стандартной группе проводили на первом этапе лучевую терапию 5,5 недель, через 8 недель выполнялось хирургическое лечение, в дальнейшем проводилась адъювантная терапия FOLFOX/CAPEOX в течение 24 недель. В экспериментальной группе вначале также проводили лучевое лечение, но более коротким режимом – 5×5 Гр, далее проводили FOLFOX/CAPEOX в течение 18 недель, затем выполняли хирургическое лечение.
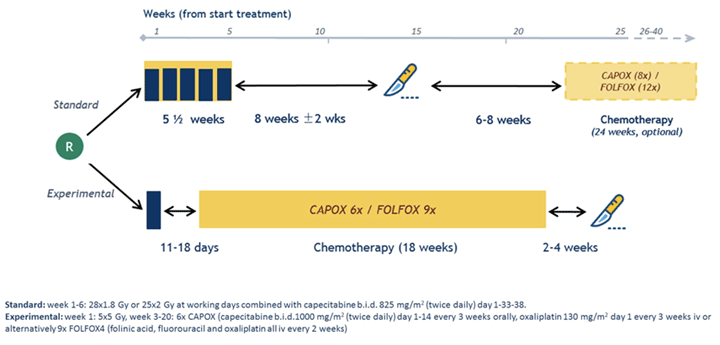
Было получено снижение риска рецидива болезни, связанного с лечением, на 7%, риска появления отдаленных метастазов на 7%, увеличение частоты полных патоморфологических ответов с 14% до 28%, весь период лечения был менее продолжительным при проведении экспериментального варианта. Однако этот режим лечения не оказал влияния на 3-летнюю ОВ: в обеих группах она составила 89%.
Литература: