08.04.2020
 Болотина Лариса Владимировна
Болотина Лариса Владимировна
МНИОИ им. П.А. Герцена –
филиал ФГБУ «НМИЦ радиологии»,
Москва
 Шепель Артем Олегович
Шепель Артем Олегович
Городская клиническая больница
имени Д.Д. Плетнёва –
Онкологический диспансер,
Москва
В нашей стране за последнее десятилетие отмечается устойчивая динамика снижения смертности от уротелиального рака несмотря на то, что показатель заболеваемости возрос за указанный период [1]. По данным российского канцер-регистра известно, что в 2008 году впервые диагноз рака мочевого пузыря (РМП) был установлен 13002 пациентам, тогда как в 2018 году уже 17426. Однако в указанные годы от уротелиального рака умерло 6872 и 6132 пациентов соответственно. В первую очередь эти успехи связаны с существенным расширением терапевтических возможностей распространенных форм патологии.
Говоря о подходах к терапии резектабельных мышечно-инвазивных (МИ) местнораспространенных форм РМП, необходимо отметить, что все чаще в практике используют периоперационную платиносодержащую химиотерапию. Наверное, несколько подробнее стоит сказать об адъювантном лечении. Накапливается все больше данных о целесообразности проведения этого этапа лечения [2]. На недавно прошедшем конгрессе ASCO GU 2020 были представлены результаты английского исследования, объединившего результаты лечения 260 пациентов с диагностированным раком верхних отделов уротелиального тракта pT2-T4pN0-N3M0 или pTлюбоеN1-N3M0, перенесших нефруретерэктомию [3]. В течение ближайших 90 дней после операции части больных назначалась адъювантная химиотерапия (АХТ) – 4 цикла в режиме цисплатин 70 мг/м2 или карбоплатин AUC 4,5/5,0 в 1 день + гемцитабин 1000 мг/м2 в 1 и 8 дни каждые 3 недели. Другая часть дополнительного лечения не получала. К медиане наблюдения 30,3 месяца было зафиксировано достоверное снижение риска рецидива или смерти на 55% в группе пациентов, получавших АХТ. Показатель 3-летней безрецидивной выживаемости составил 71% и 46% соответственно. Медиана длительности безрецидивного периода в лечебной группе достигнута не была, тогда как в группе больных, находившихся под наблюдением, составила 29,8 месяца. Также достоверно ниже (на 52%) оказался и риск развития отдаленных метастазов и смерти в исследовательской группе. Показатель зафиксированной 3-летней выживаемости без метастазов составил 71% и 53% соответственно. Данные по общей выживаемости на момент представления результатов исследования оказались незрелыми, анализ этого показателя авторами планируется провести в последующем. Конечно, не стоит забывать, что проведение платиносодержащей химиотерапии сопровождается нежелательными реакциями (НР). Так, в представленном исследовании авторы сообщают о 44% НР 3-5 степени при проведении АХТ в сравнении с 4% в группе наблюдения. Основными из них были нейтропения, тромбоцитопения, тошнота, фебрильная нейтропения и рвота. Безусловно, с учетом того, что упомянутое исследование позволило ярко продемонстрировать увеличение беспрогрессивной выживаемости, которая рассматривается лишь как суррогатный параметр эффективности, в отличие от общей выживаемости, в ходе дискуссии по результатам протокола было высказано предложение о том, что специалистам необходимо самим принимать решение, насколько полученные данные могут поменять в настоящее время клиническую практику. Таким образом, все большему числу пациентов рекомендуется использование лекарственной терапии при первичном лечении, и, соответственно, платиносодержащие режимы реализуют свою эффективность уже в самом начале противоопухолевого лечения.
В отношении неоадъювантной химиотерапии (НАХТ) существует более единый взгляд на необходимость ее применения при мышечно-инвазивном РМП (МИРМП) [2, 4, 5, 6]. Тем не менее, предпринимаются попытки определения более эффективного режима, чем стандартный GemCis (цисплатин и гемцитабин) или дозоуплотненный вариант MVAC (метаторексат, винбластин, доксорубицин, цисплатин). Так, в 2018 году были представлены результаты исследования PURE-01 с небольшим числом участников (50 пациентов с мышечно-инвазивным уротелиальным РМП). Среди них 54% была установлена стадия cT3, 42% – cT2 и 4% – cT2-3N1. Сорока девяти из них до цистэктомии проводилось 3 введения пембролизумаба 200 мг каждые 3 недели. У 21 (42,0%) пациента удалось достичь полного патоморфологического ответа (пПО, pT0), дополнительно у 6 больных резидуальная опухоль была представлена pTa, pTis или pT1. Таким образом, у 27 (54,0%) зафиксировано «снижение» стадии до неинвазивного варианта опухоли. Авторы отметили, что пациенты с PD-L1-позитивным раком лучше отвечали на иммунотерапию, чем PD-L1-негативные. Особого внимания заслуживает тот факт, что более половины (54,3%) из 35 больных с CPS 10 и более достигли пПО в сравнении с 13,3% из 15 с CPS менее 10 [7]. Результаты еще одного исследования 2 фазы BLASST-1 были доложены на ежегодном конгрессе ASCO GU в феврале 2020 года. В протокол был включен 41 пациент МИРМП, которым до операции назначались 4 курса комбинированного лечения: химиотерапия в режиме GemCis в сочетании с ниволумабом [8]. Распределение по стадиям было следующим: T2N0 – 90%, T3N0 – 7% и T2-4N1 – 3%. Основной целью являлось достижение патоморфологического ответа, при котором резидуальная опухоль была представлена мышечно-неинвазивным компонентом. Патоморфологический ответ составил 66%: 51,8% достигли pT0, у 7,4% резидуальная опухоль была представлена pT1, из них у 18,5% – pTa, и 22,2% – pTis. Таким образом, пПО, определяемый как pT0 and pTis, составил 49%. Обобщая данные литературы, необходимо вновь подчеркнуть, что у большого числа больных как платиносодержащие режимы химиотерапии, так и в ближайшем будущем возможно анти-PD-1/PD-L1 препараты будут реализовывать свою эффективность уже на ранних этапах лечения резектабельных процессов. Все это максимально актуализирует проблему грамотного выстраивания последующих линий терапии.
Среди цитостатиков, зарегистрированных для лечения РМП, и единственным доказавшим свою эффективность после препаратов платины в рандомизированном исследовании III фазы является винфлунин. Также необходимо помнить, что от 30% до 50% пациентов не могут получать «золотой» стандарт 1 линии лечения – платиносодержащие режимы ХТ – в силу нарушения функции почек и общего состояния, связанного с возрастом и сопутствующими заболеваниями [9]. Известно, что основными противопоказаниями к использованию цисплатина являются клиренс креатинина <60 мл/мин. (1 мл/сек.), ECOG >1 или индекс Карновского ≤70%, периферическая нейропатия >1 степени (CTCAE версия 4), потеря слуха >1 степени (CTCAE версия 4) или сердечная недостаточность III класс по NYHA.
При невозможности назначения цисплатина ХТ имеет ограниченную эффективность. В 2007 году были опубликованы результаты исследования по прямому сравнению платиновых производных в сочетании с гемцитабином у пациентов с распространенным уротелиальным раком (УТР) [10]. Авторами убедительно была продемонстрирована существенно более высокая эффективность режима GemCis в сравнении с GemCarbo как по частоте объективного ответа (65,9% vs 56,4%) и возможности достижения полной регрессии опухоли (19,5% vs 2,6%), так и по медиане ОВ (12,8 мес. vs 9,8 мес.) и особенно показателю годичной выживаемости (63,6% vs 37,3%). Для группы больных с невозможностью использования препаратов платины в качестве 1 линии предусмотрена возможность применения иммуноонкологических препаратов [11, 12]. Однако необходимо отметить, что эффективность терапии как анти-PD-L1, так и анти-PD1 блокаторами нарастает при увеличении уровня экспрессии лиганда [13, 14].
На протяжении 10 лет винфлунин остается единственным цитостатиком, продемонстрировавшим статистически значимое преимущество по сравнению с наилучшей поддерживающей терапией после препаратов платины, у пациентов распространенным УТР (n=253) в отношении частоты объективных ответов (ЧОО) (8,6% vs. 0%; р=0,0063), медианы беcпрогрессивной выживаемости (3,0 мес. vs. 1,5 мес.; р=0,0012) и общей выживаемости (ОВ) (6,9 мес. vs. 4,3 мес.; р=0,0403) [15]. Конечно, полученные результаты вряд ли могут расцениваться как высокие. К тому же могут существовать опасения недостижения даже подобных результатов в реальной практике, что характерно для многих рандомизированных исследований. Это связано в первую очередь со строгим отбором пациентов в исследовательские протоколы. Именно поэтому представляет огромный интерес анализ эффективности винфлунина в условиях клинического использования у пациентов, имеющих более широкие критерии возможного применения препарата. Наиболее значимым является обобщенный опыт применения винфлунина в европейских странах (n=750), который позволил выявить группу максимальной его эффективности [16-22]. Оказалось, что у пациентов, сохраняющих ECOG 0, уровень гемоглобина более 100 г/л и без метастазов в печени, медиана ОВ составила 11,7-17,6 месяца. И вот если провести, конечно, не очень корректное, сравнение показателя медианы ОВ из разных исследований, то мы увидим, что во 2 линии терапии после применения платиносодержащих режимов иммуноонкологические препараты обеспечивают более скромные результаты. Так, применение во 2 линии атезолизумаба, ниволумаба и пембролизумаба привело к достижению медианы ОВ в 8,6 мес., 8,6 мес. и 10,1 мес. соответственно [23-25]. Полученные данные позволяют рассматривать винфлунин как оптимальный выбор для пациентов без факторов неблагоприятного прогноза, к которым относят ECOG >0, гемоглобин <100 г/л и метастазы в печени, или имеющих не более 1 фактора, получивших платиносодержащую ХТ. Дополнить эту группу могут пациенты с абсолютными противопоказаниями к назначению препаратов платины, которым в 1 линии лечения использовались блокаторы точек иммунного ответа.
Для демонстрации эффективности винфлунина в клинической практике приведем несколько клинических наблюдений.
Пациентка Б., 66 лет. Диагноз: рак мочевого пузыря T3N3M1 метастатическое поражение печени, легких. Морфологическое заключение №6754/17 уротелиальный рак с поражением глубокого мышечного слоя.
Анамнез: в мае 2017 года отметила появление периодической примеси крови в моче, через месяц присоединились боли в грудной клетке, периодический кашель. При обследовании установлен диссеминированный рак мочевого пузыря с метастатическим поражением легких и печени. В качестве первой линии получила 8 курсов химиотерапии по схеме карбоплатин AUC 5 в 1 день + гемцитабин 1000 мг/м2 1, 8 дни 21-дневного цикла. При обследовании в январе 2018 года (КТ органов грудной и брюшной полостей) зафиксировано прогрессирование метастатического процесса в виде появления дополнительных очагов в легких, рост ранее выявленных очагов в легких и печени, поражение лимфоузлов бронхопульмональной группы. Пациентка сохраняла хороший функциональный статус (ECOG 0-1), нормальный уровень гемоглобина (123 г/л), в связи с чем с января 2018 года как 2 линия лечения начата терапия винфлунином 280 мг/м2 1 раз в 3 недели (дозировка 280 мг/м2 обусловлена эпизодами токсичности в виде нейтропении при предыдущих курсах лечения). После первого введения в дозе 280 мг/м2 отмечена удовлетворительная переносимость винфлунина, в связи с чем лечение продолжено в избранной дозе. При обследовании после 4 курсов отмечена положительная динамика в виде уменьшения размеров всех ранее выявленных очагов (в паренхиме легкого и печени, лимфоузлов средостения) (рис. 1).
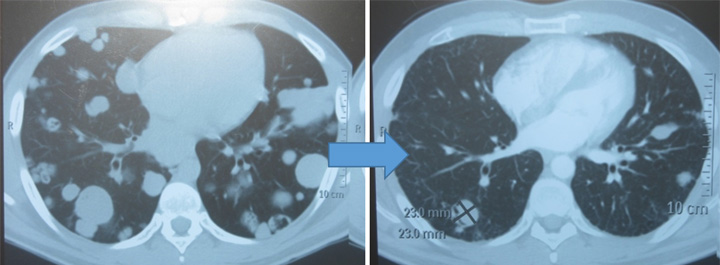
Рисунок 1. Пациентка Б. Динамика очагов в легких после 4 курсов терапии винфлунином (2 линия).
Лечение продолжено по прежней схеме. Всего с января 2018 года по декабрь 2018 года пациентка получила 17 курсов монохимиотерапии винфлунином со стабилизацией достигнутого эффекта. Представленное наблюдение подтверждает ранее изложенные факты о высокой эффективности винфлунина у пациентов, имеющих не более 1 фактора неблагоприятного прогноза. Выживаемость без прогрессирования на фоне малотоксичного режима лечения составила 12 месяцев.
Второе клиническое наблюдение касается более молодого больного.
Пациент Р., 52 года. Диагноз: Рак мочевого пузыря рT2bN0M0. Морфологическое заключение №4484/15: уротелиальный рак с поражением глубокого мышечного слоя.
Анамнез: с декабря 2014 г. появились жалобы на примесь крови при мочеиспускании. При обследовании установлен рак мочевого пузыря. 13.01.2015 выполнено хирургическое лечение в объеме цистпростатвезикулэктомии. В последующем находился под динамическим наблюдением. При контрольном обследовании в апреле 2017 года выявлено прогрессирование заболевания в виде появления множественных гиперметаболических очагов в паренхиме обоих легких, увеличение лимфоузлов средостения. КТ органов грудной полости 13.04.2017 года: отмечается появление множественных очаговых образований в паренхиме обоих легких, максимальный размер 24 мм, увеличение лимфоузлов средостения. С мая 2017 года по август 2017 года проведено 4 курса 1 линии химиотерапии в режиме CemGis (цисплатин 80 мг/м2 в 1 день + гемцитабин 1000 мг/м2 в 1, 8 дни 21-дневного цикла). По данным контрольного обследования зафиксирована отрицательная динамика. КТ органов грудной полости, МРТ малого таза (сентябрь 2017 года): отмечается увеличение очагов в легких при сравнении с ранее измеряемыми очагами 35 мм (ранее 24 мм), появление объемного образования в малом тазу размерами 35×25 мм, накапливающего контраст. С сентября 2017 года по апрель 2018 года пациент получал комбинированную терапию (иммунотерапия + химиотерапия) в рамках клинического протокола. По данным контрольного обследования (КТ органов грудной полости, МРТ малого таза) от мая 2018 года вновь отмечена отрицательная динамика в виде увеличения очагов в легких и рост объемного образования в малом тазу.
В качестве 3 линии терапии больному проведено 3 курса монотерапии винфлунином 320 мг/м2 1 раз в 3 недели. При контрольном обследовании в июле 2018 года отмечена положительная динамика в виде уменьшения очагов в паренхиме легкого, лимфоузлов средостения и размеров объемного образования в малом тазу. Всего пациент получил 11 курсов винфлунина без редукции дозы со стабилизацией достигнутых изменений. Лечение завершено в феврале 2019 года в связи с появлением неврологической симптоматики (правосторонний гемипарез). Выполнено дополнительное обследование (МРТ головного мозга с в/в контрастированием), при котором выявлены множественные метастазы в головном мозге.
Данное клиническое наблюдение демонстрирует возможность применения винфлунина у молодого пациента, казалось бы, с полностью исчерпанными возможностями самого эффективного лечения. Использование препарата позволило не только достичь частичного ответа, но и сохранять его длительное время (9 месяцев).
Таким образом, можно с уверенностью утверждать, что, несмотря на расширившиеся возможности лекарственной терапии распространенного УТР, имеющиеся в арсенале цитостатики не только сохраняют свое место в ряду эффективных лекарственных средств, но и заставляют клиницистов решать новые задачи, главной из которых является определение грамотной последовательности использования препаратов разных классов для выстраивания наиболее оптимальной и длительной лечебной стратегии в терапии этой сложной патологии.
Список литературы:
Статья предоставлена компанией «Пьер Фабр». Публикуется в редакции авторов.