06.05.2016
В статье, опубликованной недавно в журнале the Nature Medicine, группа исследователей (Университетская клиника Шлезвиг-Гольштейн, Киль, Германия) описывают новый сигнальный путь, который аккумулирует сигналы, полученные от микроокружения опухоли, и способствует развитию злокачественных новообразований органов желудочно-кишечного тракта (ЖКТ). По результатам их исследования оказалось, что кальцинеурин эпителиальных клеток стимулирует развитие опухоли не за счет влияния на ее микроокружение, а за счет «реагирования» в ответ на изменение состава микроокружения опухоли. Возможно, данный путь может стать новой терапевтической мишенью для таргетных препаратов.
В работе представлена информация о том, что изменение состава микроокружения опухоли, в частности увеличение числа микробактерий, способствует нарушению барьерной функции эпителия и развитию колоректального рака (КРР).
Как известно, воспаление является фактором риска развития КРР. Существуют данные о том, что даже при отсутствии клинических признаков воспаления патоген-ассоциированные сигнальные пути способствуют развитию КРР. Таким образом, данные сигнальные пути, в которых центральная роль отводится клеткам миелоидного и лимфоидного ряда, остаются активными и в клетках кишечного эпителия и стимулируют развитие опухоли.
Кальцинеурин, или кальций-зависимая фосфатаза, играет важную роль в иммунном ответе, которая заключается в дефосфорилировании и активации ядерного фактора активированных Т-клеток (NFAT) семейства факторов транскрипции. В представленной работе исследователи изучили роль кальцинеурина в развитии опухоли ЖКТ.
В своей статье они опубликовали данные о том, что благодаря важной роли, которую играет кальцинеурин в реакциях иммунного ответа, ингибиторы кальцинеурина широко используются для подавления нежелательных реакций иммунной системы, в частности, возникающих при трансплантации солидных органов. В связи с этим подавление кальцинеурина лекарственными препаратами способствует увеличению частоты развития злокачественных новообразований солидных органов, и в частности, КРР. В отличие от этих наблюдений in vivo, ингибирование кальцинеурина и NFAT в клеточных линиях КРР in vitro подавляет рост клеток КРР. Тем самым встает вопрос об онкогенной роли кальцинеурина и NFAT в развитии КРР. Основные результаты проведенной работы представлены на рис. 1.
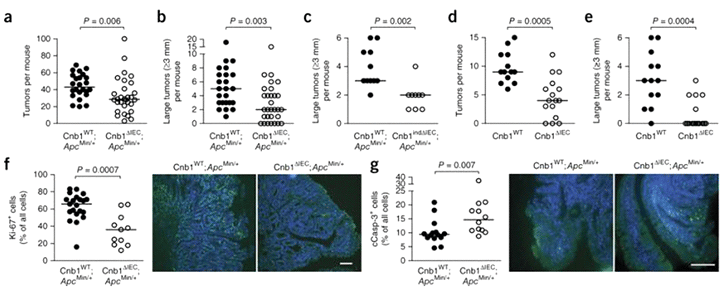
Рисунок 1. Кальцинеурин кишечного эпителия способствует развитию злокачественных новообразований ЖКТ.
Исследователи показали, что клетки кишечного эпителия продуцируют как кальцинеурин, так и NFAT, выработка которых увеличивается при нарушении состава микроокружения опухоли. У мышей кальцинеурин способствует развитию опухоли ЖКТ за счет нарушения функции стволовых опухолевых клеток, активация которых у человека способствует стремительному развитию заболевания.
В ходе проведения своих экспериментов на мышах исследователи обнаружили увеличение числа микробактерий в аденомах кишки. На основании этого они предположили, что изменение состава клеточного микроокружения способствует повышению экспрессии кальцинеурина эпителия.
В полученных ими результатах оказалось, что кальцинеурин и факторы NFAT продуцируются клетками кишечного эпителия и селективно активизируются в опухолях ЖКТ вследствие нарушения состава микроокружения опухоли. Кальцинеурин клеток эпителия стимулирует пролиферацию стволовых опухолевых клеток независимо от NFAT и способствует развитию опухолей ЖКТ у мышей.
Результаты проведенной работы в очередной раз подчеркивают роль микроокружения в развитии КРР и позволяют по-новому взглянуть на взаимосвязь между изменением состава микроокружения опухоли, повышением экспрессии кальцинеурима и ростом злокачественного новообразования.
Источник: Peuker K, Muff S, Wang J, et al. Epithelial calcineurin controls microbiota-dependent intestinal tumor development. Nature Medicine 2016; Published online 4 April. doi:10.1038/nm.4072.