25.03.2016
Почечно-клеточный рак (ПКР) является самым распространенным злокачественным новообразованием почки у взрослых. Ежегодно данное заболевание выявляется у 214 000 человек в мире, треть из которых умирает от метастатического процесса [1]. На сегодняшний день стандартным подходом к терапии больных с локализованными стадиями болезни, находящимися в группе высокого риска рецидива заболевания, остается радикальное хирургическое лечение с активным динамическим наблюдением.
Риск развития рецидива заболевания зависит как от клинических признаков заболевания, так и от гистологических особенностей и распространенности опухолевого процесса [2-4]. Результаты всех ранее проведенных исследований, изучавших эффективность адъювантного применения интерлейкина 2, гормональной терапии или химиотерапии у больных с локализованной стадией ПКР, находящихся в группе высокого риска рецидива заболевания, были отрицательными [5]. Аналогичными были результаты адъювантной терапии интерфероном, потенциально обладающим антиангиогенным и иммуностимулирующим эффектами [5].
С другой стороны, ПКР безусловно является одним из заболеваний, на примере которого можно изучать роль адъювантной терапии антиангиогенными препаратами.
Применение таких ингибиторов тирозинкиназ рецептора фактора роста эндотелия сосудов (ТКИ VEGFR), как сунитиниб и сорафениб, увеличивает показатель выживаемости без прогрессирования (ВБП) больных с распространенной формой заболевания [6, 7]. Более того, последовательное применение этих и других ингибиторов ТКИ при метастатическом процессе позволило увеличить медиану общей выживаемости (ОВ) пациентов с 13 мес. до 29 и более мес. [8, 9]. Роль ингибиторов VEGFR в адъювантной терапии больных ПКР до сих пор остается предметом изучения. В исследовании, опубликованном в The Lancet Oncology, впервые было проведено сравнение безрецидивной выживаемости (БРВ) у больных с первично удаленным ПКР, находящихся в группе высокого риска рецидива и получающих адъювантную терапию сорафенибом или сунитинибом ± плацебо [10].
В этом двойном слепом рандомизированном исследовании 3 фазы, проведенном в 226 клинических центрах США и Канады, приняло участие в общей сложности 1943 больных ПКР. Все участники исследования имели как минимум pT1b стадию заболевания, полностью удаленную первичную опухоль, отсутствие признаков отдаленного метастазирования. В зависимости от риска развития рецидива заболевания (промежуточный, высокий или очень высокий), данных гистологии (светлоклеточный или несветлоклеточный), статуса пациента по шкале ECOG (0 или 1) и объема оперативного вмешательства (лапароскопия или открытая операция) все больные были рандомизированы в соотношении 1:1:1 в три группы. Первая группа (n=647) получала сунитиниб (50 мг × 1 р/д перорально в течение 4 недель, каждые 6 недель), вторая (n=649) – сорафениб (400 мг × 2 р/д перорально ежедневно) и третья (n=647) – плацебо. Лечение продолжалось в течение 54 недель.
Основным критерием эффективности была оценка показателя БРВ между сравниваемыми группами. Помимо этого оценивались показатель ОВ и профиль безопасности препаратов.
По результатам данного исследования при медиане наблюдения 5,8 (4,9 – 6,9) лет медиана БРВ в группе больных, получавших сунитиниб, составила 5,8 лет или 70 мес. (ОР 1,02; 97,5% ДИ 0,85–1,23; p=0,8038), в группе, получавшей сорафениб, – 6,1 лет или 73,4 мес. (ОР 0,97; 97,5% ДИ 0,80–1,17; p=0,7184) и в группе плацебо – 6,6 лет или 79,6 мес. Результаты по БРВ представлены на рис 1.
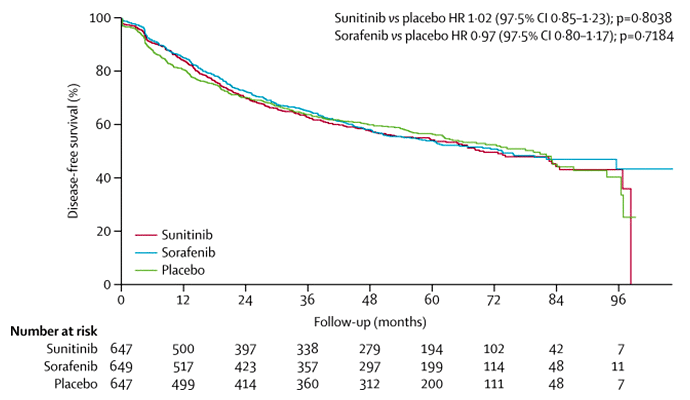
Рисунок 1. Безрецидивная выживаемость больных в исследовании ECOG-ACRIN E2805.
Аналогичные результаты были выявлены при проведении подгруппового анализа, куда вошли больные только светлоклеточным ПКР (66,9 мес., 66,9 мес. и 74,4 мес.). Предварительные результаты по показателю ОВ также не выявили различий между сравниваемыми группами.
Среди нежелательных явлений 3 и более степени чаще всего встречались гипертензия (105/647 [17%] больных в группе сунитиниба и 102/649 [16%] больных в группе сорафениба), ладонно-подошвенный синдром (94 [15%] и 208 [33%] соответственно), кожная сыпь (15 [2%] и 95 [15%] соответственно), усталость (110 [17%] и 44 [7%] соответственно). Летальный исход, обусловленный проводимой терапией, был зарегистрирован у 1 больного, получавшего сорафениб, и у 4 пациентов, находившихся на терапии сунитинибом.
На основании результатов проведенного исследования авторами был сделан вывод о том, что адъювантная терапия ингибиторами ТКИ VEGFR сорафенибом или сунитинибом не влияет на увеличение выживаемости изученной когорты больных. Помимо развития нежелательных явлений, ряд из которых привел к летальному исходу пациентов, полученные результаты явно свидетельствуют против применения данных препаратов в адъювантной терапии больных ПКР, входящих в группу высокого риска рецидива. Как бы то ни было, данное исследование явилось одним из доказательств того, что биология рецидива ПКР не зависит от ангиогенеза опухоли.
Литература: