19.09.2012
С 2006 года таргетная терапия широко используется для лечения метастатического почечно-клеточного рака (мПКР). За 5 лет накоплен большой опыт применения таргетных препаратов, стало возможным оценивать отдаленные результаты терапии, а именно влияние на продолжительность жизни больных.
Важным является поиск факторов, определяющих выбор препарата. Есть факторы, которые одинаково влияют на эффективность того или иного агента. К ним можно отнести статус по шкале ECOG, изменение уровня ЛДГ, гиперкальциемию, снижение гемоглобина, количество метастатически измененных органов, число нейтрофилов и тромбоцитов, а также насколько вовремя было начато лечение по поводу метастатической болезни и проводилась ли нефрэктомия – то есть факторы, определяющие течение самой болезни. Как известно, в различных модификациях данные факторы складываются в прогностические модели (модели Motzer, 2000; Hudes, 2007; Heng, 2009) и делят пациентов на группы гипотетически благоприятного, промежуточного или плохого прогноза, что сказывается на результатах выживаемости. Эффективность любого таргетного препарата вне зависимости от его механизма действия равнозначно снижается от благоприятного к промежуточному прогнозу.
Между тем, есть факторы, непосредственно связанные с лечением, являющиеся его результатом, которые могут влиять на продолжительность жизни. Речь идет о частоте ответов на фоне анти-VEGF(R) терапии.
Долгое время данному критерию эффективности таргетной терапии отводилась второстепенная роль. Основной задачей было увеличение выживаемости без прогрессирования как показателя времени контроля над болезнью. Однако в последний год значение развития ответа у пациента, получающего таргетный препарат, изменилось. Теперь это один из предикторов продолжительности жизни.
Частота ответов и ее влияние на продолжительность жизни
Частота ответов при лечении ингибиторами тирозинкиназы и моноклональными антителами, воздействующими на путь VEGF/VEGFR, колеблется от 5% (для сорафениба в первой линии) до 47% (для сунитиниба в первой линии) (табл. 1).
Таблица 1. Частота ответов и ее влияние на продолжительность жизни.
| Препарат | Исследование | Частота ответов |
|---|---|---|
| Сунитиниб [1] | III фаза (Motzer et al) Пациенты, не получавшие лечение |
47% |
| Сунитиниб [2] | II фаза (Motzer et al) После прогрессирования на цитокинах |
42% |
| Пазопаниб [3] | III фаза (Sternberg et al.) Пациенты, не получавшие лечение |
32% |
| Пазопаниб [3] | III фаза (Sternberg et al.) После прогрессирования на цитокинах (подгруппа) |
29% |
| Бевацизумаб+ИФН [4] | AVOREN (Escudier et al.) Пациенты, не получавшие лечение |
31% |
| Бевацизумаб+ИФН [5] | CALGB (Rini et al.) Пациенты, не получавшие лечение |
25,5% |
| Сорафениб [6] | TARGET (Escudier et al.) После прогрессирования на цитокинах |
10% |
| Сорафениб [7] | II фаза (Escudier et al.) Пациенты, не получавшие лечение |
5% |
В этом году на конгрессе ASCO несколькими авторами были представлены результаты влияния частоты ответов на выживаемость больных мПКР.
Wanling Xie с соавт. (abstract 4538) [8] проанализировали 2161 больных с мПКР, которые получали таргетную терапию. Из общей группы были выделены пациенты (N=152), живущие долго (медиана 69,3 мес.), и пациенты (N=218) с короткой продолжительностью жизни (медиана 3,1 мес.). Обе группы были сравнены по основным прогностическим факторам, относящимся к модели Heng. Неудивительно, что в группе с короткой продолжительностью жизни было достоверно больше пациентов с промежуточным и плохим прогнозом (P<0.0001). Также авторы проанализировали частоту объективных ответов на лечение как независимый прогностический фактор, влияющий на продолжительность жизни. В группе больных, живущих дольше, частота ответов составила 38%, кроме того, стабилизация болезни была зафиксирована у 53% больных. У пациентов с короткой продолжительностью жизни частота ответов была только 4% и низкая частота стабилизаций – 19%. Авторы установили достоверную зависимость частоты ответов на таргетный препарат и продолжительности жизни: чем выше частота, тем дольше продолжительность (P<0.0001).
В другой работе, которая обсуждалась на ASCO 2012, A. Molina с соавт. (abstract 4542) [9] также делают вывод о влиянии частоты ответов на продолжительность жизни в группе 1059 больных мПКР, которые в рамках II и III фаз клинических исследований получали сунитиниб в стандартном режиме (50 мг, ежедневно, 4 недели терапии, 2 недели перерыва). Пациенты, ответившие на терапию, а это в общей выборке леченных и нелеченных больных – 38%, имели лучший статус по шкале ECOG, чаще благоприятный прогноз согласно модели MSKCC, больший период с момента постановки диагноза, нефрэктомию в анамнезе и отсутствие костных метастазов на момент выявления опухоли (P<0.05). В этом нет ничего удивительного: это исследование в очередной раз подтвердило значение состояния пациента до начала таргетной терапии. Находкой стало доказательство независимого влияния развития ответа на продолжительность жизни. Так, медиана общей выживаемости в группе ответивших пациентов составила 40,1 мес., что на порядок больше по сравнению с выживаемостью в группе неответивших больных на сунитиниб – медиана 14,5 мес. (P<0.001). Значимым является сам факт достижения ответа, и неважно, ранний это ответ или поздний (отличий в выживаемости между пациентами с ранним и поздним ответом не получены) (P=0.1438).
Третье исследование, представленное на ASCO 2012, посвящено той же теме – увеличивается ли продолжительность жизни больных с ростом частоты ответов (Viktor Gruenwald с соавт, abstract 4631) [10]. Ответ у 83 включенных больных мПКР, получавших таргетную терапию в первой линии, оценивался по критериям RECIST 1.1. В однофакторном анализе было установлено, что неответившие на лечение пациенты имеют достоверно худшие результаты выживаемости (P<0.0001). Сокращение диаметров очагов на <10% против ≥10% также влияло на общую выживаемость: 14,5 мес. против 29,1 мес. соответственно (P=0.001). В многофакторном анализе проводилась оценка уменьшения размера очагов на ≥10% как независимого от других факторов предиктора. Действительно, сокращение объема опухолевой массы оказалось независимым предиктивным фактором лучшей выживаемости (HR 0.306; 95% ДИ 0.152-0.612).
Еще одна интересная работа, опубликованная в J European Urology [11], подтверждает прогностическую роль ответа, но уже со стороны первичной опухоли, при лечении таргетными препаратами. В ретроспективное исследование включено 75 больных мПКР с неудаленной по разным причинам первичной опухолью, получавших сунитиниб в качестве первой линии терапии. Все больные имели промежуточный или плохой прогноз согласно модели MSKCC. Эффект лечения оценивался путем измерения очагов, в том числе и диаметра первичной опухоли, на протяжении лечения, используя компьютерную томографию (КТ). Снимки КТ были пересмотрены двумя независимыми экспертами. Под ранним ответом со стороны первичной опухоли подразумевалось уменьшение ее размера на ≥10% в течение первых 60 дней терапии. Первичная опухоль была большой: медиана диаметра составила 9,7 см. У пациентов, имеющих ранний ответ, сокращение размера первичной опухоли составило 36,4%. Используя многофакторный анализ, авторы определили, что ранний ответ на лечение сунитинибом со стороны первичной опухоли является предиктором более долгой выживаемости (HR: 0.26; p=0.031), медиана которой была 30,2 мес. (2,5 года). Результат весьма впечатляет, учитывая неблагоприятную по прогностическим признакам группу больных, к тому же с неудаленной первичной опухолью. Также достоверные отличия в выживаемости были получены у неответивших пациентов на лечение и больных с ответом, который развился спустя 60 дней (P<0,05). Кривые выживаемости представлены ниже.
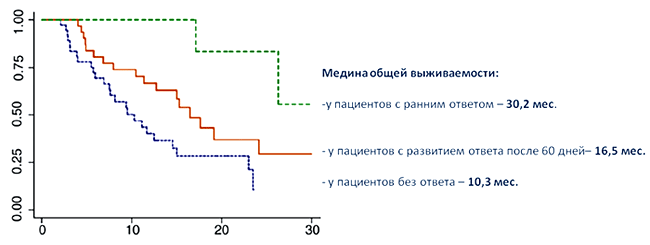
Результаты приведенных исследований демонстрируют, что в случае развития ответа на лечение можно ожидать существенного увеличения периода жизни пациента – до 5 и более лет. Следовательно, выбор препарата до начала лечения должен быть основан на знаниях о его эффективности в отношении развития потенциального ответа.
И.В. Тимофеев
Бюро по изучению рака почки Российского общества клинической онкологии, Москва
Литература
«Информация для медицинских работников» SUT-12-10.