18.07.2012
С.А. Тюляндин
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Две публикации в недавних номерах Journal of Clinical Oncology посвящены выбору адъювантной химиотерапии у больных операбельным раком молочной железы [1,2]. В работе Giordano et al. [1] анализируется частота назначения антрациклин-содержащих и таксан-содержащих (безантрациклиновых) комбинаций для проведения адъювантной терапии с 1998 по 2009 год по базам данных страховки Medicare и частных страховых компаний США (около 35 000 больных). Авторы отмечают, что в анализируемой когорте начиная со второй половины 2005 года происходит снижение частоты назначения антрациклин-содержащих комбинаций и значительно растет частота назначения таксан-содержащих (см. рис.1).
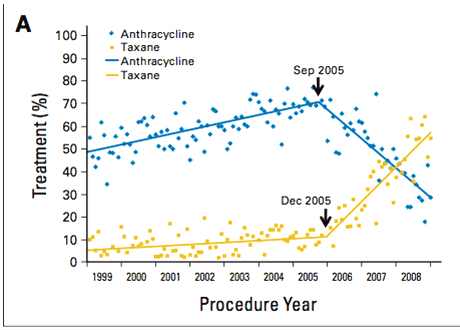
Рисунок 1. Частота назначения антрациклин-содержащих и таксан-содержащих комбинаций для проведения адъювантной терапии больных раком молочной железы (Giordano SH et al., JCO 2012, 30:2232).
Это снижение наблюдается во всех возрастных группах, при всех фенотипах заболевания и не зависит от географии проведения лечения. Несмотря на падение, антрациклин-содержащие комбинации все еще чаще назначаются женщинам моложе 65 лет с HER2-негативным раком молочной железы, в то время как пожилым и больным любого возраста с HER2-позитивным раком чаще назначают безантрациклиновые комбинации на основе таксанов. Это связано с публикацией и представлением на международных конгрессах в 2005 году предварительных результатов исследований US Oncology trial 9735 и BCIRG 006 [3,4]. Окончательные результаты этих исследований были опубликованы позднее [5,6].
В исследовании 9735 проведено сравнение эффективности и токсичности назначения 4 курсов комбинации доцетаксел и циклофосфан (ТС) в сравнении с 4 курсами химиотерапии доксорубицин и циклофосфан (АС) [5]. Комбинации ТС достоверно улучшили результаты безрецидивной (7-летняя безрецидивная выживаемость составила 81% для ТС и 75% для АС, р.=0,033, снижение относительное риска прогрессирования на 26%) и общей (7-летняя общая выживаемость 87% и 82% соответственно, р=0,032, снижение относительного риска смерти составило 31%) выживаемости (см. рис. 2). Улучшение результатов лечения наблюдалось независимо от возраста, статуса гормональных рецепторов и HER2.
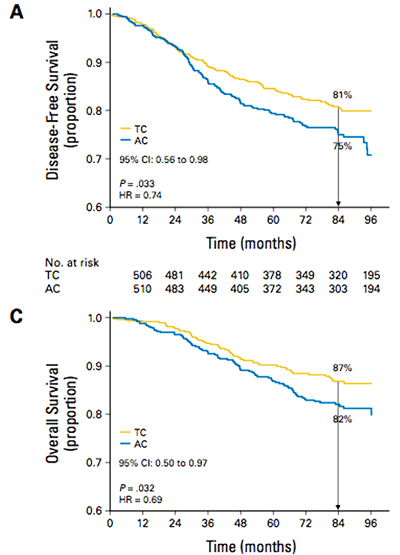
Рисунок 2. Кривые безрецидивной и общей выживаемости больных раком молочной железы,
получавших адъювантную химиотерапию комбинациями ТС и АС в рамках исследования US Oncology trial 9735
(Jones SE et al. J Clin Oncol 2009 27:1177-1183).
Это улучшение результатов лечения было достигнуто при умеренном усилении гематологической токсичности в группе ТС (частота фебрильной нейтропении 5% для ТС и 2,5% для АС) и равной кардиотоксичности (или скорее ее отсутствии, ибо клинически значимая сердечная недостаточность была зарегистрирована только у одной больной в группе АС). Полученные результаты дали основание рекомендовать назначение безантрациклиновой комбинации ТС для проведения адъювантной терапии больным раком молочной железы.
В исследовании BCIRG 006 проведена оценка эффективности добавления трастузумаба к различным режимам адъювантной химиотерапии: антрациклиновый ACTH (доксорубицин, циклофосфан, доцетаксел, трастузумаб) и безантрациклиновый TCH (доцетаксел, циклофосфан, трастузумаб) [6]. В контрольной группе использовали назначение режима ACT (доксорубицин, циклофосфан, доцетаксел). Добавление трастузумаба достоверно уменьшило частоту рецидивов (снижение относительного риска прогрессирования заболевания на 36% и 25% при использовании ACTH и TCH соответственно по сравнению с химиотерапией АСТ только) и обусловило тенденцию к уменьшению числа умерших от прогрессирования опухолевого процесса (снижение относительного риска смерти на 37% и 23% соответственно). В результате 5-летняя безрецидивная выживаемость составила 75% для АСТ, 81% для ТСН и 84% для АСТН.
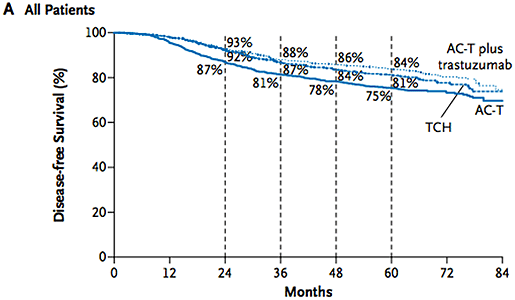
Рисунок 3. Кривые выживаемости больных HER2-позитивным раком молочной железы после адъювантной терапии в рамках исследования BCIRG 006 (Slamon D et al. N Engl J Med 2011, 365:1273-1283).
Хотя дизайн исследования не предполагал сравнение групп больных, получавших АСТН и ТСН, результаты исследования были восприняты как свидетельство равной эффективности антрациклиновых и безантрациклиновых комбинаций в сочетании с трастузумабом у больных HER2-позитивным раком молочной железы. С учетом меньшего риска возникновения кардиомиопатий авторы исследования сделали вывод о преимуществе назначения комбинации ТСН, обладающей равной эффективностью и меньшей токсичностью по сравнению с антрациклиновой комбинацией.
Результаты этих двух исследований обусловили снижение частоты назначения антрациклиновых и увеличение частоты назначения безантрациклиновых комбинаций отдельно или в сочетании с трастузумабом в качестве адъювантной терапии у больных операбельным раком молочной железы. Остается неизвестным, как эти изменения повлияли на отдаленные результаты лечения.
В июньском номере журнала Journal of Clinical Oncology опубликован комментарий, посвященный выбору режима адъювантной химиотерапии у больных HER2-позитивным раком молочной железы [2]. Добавление трастузумаба к адъювантной химиотерапии достоверно и существенно улучшает результаты лечения операбельным раком молочной железы по данным нескольких рандомизированных исследований [6-11]. Во всех этих исследованиях, ставивших первоочередную задачу по оценке эффективности трастузумаба, в качестве режимов химиотерапии использовались антрациклин-содержащие комбинации. Авторы комментария подробно и критично рассматривают цели, дизайн и результаты исследования BCIRG 006 и подчеркивают ошибочность отказа от антрациклиновых комбинаций при проведении адъювантной терапии больным HER2-позитивным раком молочной железы.
Во-первых, как уже говорилось, дизайном исследования не предполагалось сравнение двух групп больных, получавших трастузумаб, с целью определения наилучшего режима химиотерапии. Дизайн исследования предполагал лишь сравнение контрольной группы с каждой в отдельности группой химиотерапии и трастузумаба. Результаты безрецидивной выживаемости несколько лучше (на 3%) при назначении АСТН в сравнении с TCH. Это не позволяет исключить вероятность большей эффективности антрациклиновой комбинации.
Во-вторых, хотя в литературе отсутствуют данные о сравнении двух режимов химиотерапии АСТН и ТСН в качестве адъювантной химиотерапии, результаты рандомизированного исследования свидетельствуют о большей непосредственной эффективности и лучших отдаленных результатах антрациклиновых комбинаций в сочетании с трастузумабом и еженедельного паклитаксела в сочетании с трастузумабом по сравнению с ТСН в качестве предоперационной системой терапии [12].
В-третьих, предклинические и клинические данные свидетельствуют о синергизме адъювантного назначения антрациклинов и таксанов у больных HER2-позитивным раком молочной железы [13,14]. Значение карбоплатина в этой популяции больных не определено. Создание комбинации ТСН базируется на предклинических данных о синергизме производных платины и трастузумаба. Между тем, в клиническом исследовании у больных метастатическим HER2-позитивным раком молочной железы получены одинаковая эффективность комбинаций ТН и ТСН, что ставит под сомнения целесообразность добавления карбоплатина к доцетакселу [15].
В-четвертых, комбинация ACTH, возможно, не лучшая по эффективности антрациклиновая комбинация для проведения адъювантной терапии у больных HER2-позитивным раком молочной железы. Известно, что назначение антрациклинов и таксанов каждые 2 недели превосходит по эффективности 3-недельное введение этих препаратов в качестве адъювантной терапии [16]. Показано, что еженедельное введение паклитаксела является наиболее эффективным режимом назначения таксанов, особенно при совместном назначении с трастузумабом после антрациклинов при проведении адъювантной терапии [17]. Таким образом, режим АСТН может быть модифицирован на основании имеющегося клинического опыта с целью повышения эффективности и снижения токсичности.
В-пятых, основной причиной отказа от антрациклинов при проведении адъювантной химиотерапии является потенциальная кардиотоксичность препарата, которая усиливается при одновременном назначении с трастузумабом, и риск развития вторичных острых лейкозов. Частота развития вторичных лейкозов у больных в исследовании ВСIRG была одинаковой в обеих группах (по одному случаю в каждой группе за 5 лет наблюдения) [6]. Кардиомиопатии 3-4 степени отмечены у 21 больного в группе ACTH и у 4 больных в группе TCH. Однако за время наблюдения ни один больной с кардиомиопатией не умер от этого осложнения. У большинства больных со временем на фоне адекватной терапии происходит улучшение или даже нормализация сократительной способности миокарда. Разработаны критерии риска возникновения кардиомиопатии при проведении терапии трастузумабом (возраст старше 65 лет, фракция выброса левого желудочка в диапазоне 50-55%, наличие артериальной гипертензии), позволяющие снизить риск этого осложнения до 1% при назначении антрациклиновых режимов в сочетании с трастузумабом [18].
В заключение, антрациклин-содержащая адъювантная химиотерапия теряет популярность и активно замещается безантрациклиновыми комбинациями на основе таксанов. Без сомнения, выигрывают от перехода на безантрациклиновые комбинации больные с повышенным риском развития кардиомиопатии. Для остальных больных отдаленные последствия такого перехода неизвестны. Однако для больных с HER2-позитивным раком молочной железы отказ от антрациклинов выглядит преждевременным. До тех пор, пока нет свидетельств о преимуществе безантрациклиновых комбинаций, полученных при проведении правильно спланированных рандомизированных исследований, комбинации с включением антрациклинов и таксанов в сочетании с трастузумабом должны оставаться основой адъювантной терапии больных HER2-позитивным раком молочной железы.
Литература