Копнин Б.П.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
3.6. Е-кадгерин, АРС и аксин - супрессоры, контролирующие сигнальный путь β-катенин/Cdk/pRb
Наследственные и спорадические опухоли желудочно-кишечного тракта довольно часто ассоциированы с мутациями в генах Е-кадгерина, β-катенина, АРС и аксина (Табл. 1). Так, гемизиготные герминальные мутации Е-кадгерина обусловливают развитие наследственных форм рака желудка. Врожденные мутации одного из аллелей гена β-катенина или гена APC ведут к развитию семейного аденоматозного полипоза кишечника (у большинства пациентов наблюдаются мутации APC, реже встречаются мутации β-катенина). В основе онкогенного эффекта всех этих мутаций лежит повышение транскрипционной функции протоонкобелка β-катенина, вызывающего активацию циклинзависимых киназ и инактивирующего тем самым супрессорную функцию pRb (см. раздел 3.2.2). Такая функция β-катенина обусловлена его способностью транслоцироваться в ядро, связываться с транскрипционными факторами семейства TCF/LEF и активировать гены, имеющие в своем составе TCF/LEF-респонсивные элементы, в частности ген циклина D1 и онкоген MYC.
Е-кадгерин - представитель семейства трансмембранных гликопротеинов, осуществляющий адгезионные межклеточные контакты типа "зона слипания" (zona adhaerence). Его внутриклеточный домен связывается с рядом белков, в первую очередь с b-катенином. В этом случае, происходит переключение функции β-катенина: он перестает функционировать в качестве транскрипционного фактора, а взаимодействует с актиновыми микрофиламентами и участвует в регуляции реорганизации цитоскелета. Характерные для опухолей желудочно-кишечного тракта, рака молочной железы, яичника и ряда других новообразований изменения гена Е-кадгерина (мутации, делеции, метилирование) вызывают потерю экспрессии белка или изменение его локализации в клетке, что имеет два важных для онкогенеза последствия. Во-первых, нарушаются межклеточные контакты и морфогенетические реакции клетки, а, во-вторых, происходит накопление β-катенина в ядре и повышение его транскрипционной активности (Рис. 6). В результате стимулируется размножение клеток и увеличивается их способность к инвазии. Восстановление экспрессии Е-кадгерина в раковых клетках с помощью введения генно-инженерных конструкций вызывает резкое замедление пролиферации и переход от инвазивного к неинвазивному фенотипу. Причем рост-супрессирующий эффект Е-кадгерина обусловливается его способностью связывать и секвестрировать b-катенин, и не зависит от того, происходит ли при этом восстановление межклеточных контактов.
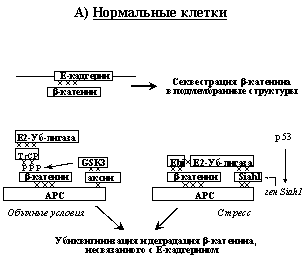
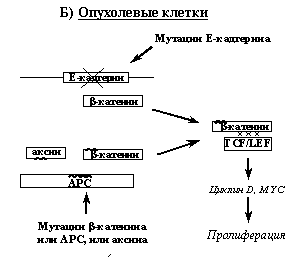
Рис. 6. Регуляция транскрипционной активности β-катенина и ее нарушения в опухолевых клетках (объяснения в тексте).
В несвязанном с Е-кадгерином состоянии β-катенин очень нестабилен. Ключевую роль в регуляции его времени жизни и транскрипционной активности играют опухолевые супрессоры APC и аксин (Рис. 6А). АРС связывает одновременно и b-катенин и аксин, в результате чего образуется сложный комплекс, к которому рекрутируется GSK-3b (киназа-3b гликогенсинтетазы). Фосфорилируя определенные сериновые остатки β-катенина, GSK-3b индуцирует связывание его с Е2-убиквитин-лигазой. Убиквитинированный b-катенин направляется в протеосомы, где происходит его деградация. При стрессах, вызывающих активацию р53, включается дополнительный механизм деградации β-катенина (Рис. 6А). В этом случае происходит повышение экспрессии белка Siah1, который рекрутирует другой тип комплексов Е2-убиквитин-лигазы также и к нефосфорилированному по N-концу b-катенину. Таким образом достигается, по-видимому, более эффективная деградация несвязанного с кадгеринами β-катенина.
Вероятно, при онкогенных мутациях Е-кадгерина свободного β-катенина становится так много, что системы его деградации не справляются и часть β-катенина оказывается в ядре, где он проявляет свою транскрипционную активность (Рис. 6Б). В клетках новообразований часто реализуется и другой путь повышения транскрипционных активностей β-катенина, связанный с нарушениями работы систем его деградации. Так, в клетках опухолей толстой кишки, печени, простаты часто обнаруживаются либо мутации β-катенина в участках, которые фосфорилируются GSK-3b и взаимодействуют с убиквитин-лигазой, либо мутации опухолевого супрессора APC, нарушающие его взаимодействие с b-катенином. либо (значительно реже) мутации аксина, отменяющие его связывание с АPC или GSK-3b. (При этом мутации APC блокируют работу обоих систем деградации β-катенина, тогда как указанные мутации самого β-катенина или аксина нарушает только одну из этих систем). В результате всех этих событий b-катенин активирует транскрипцию гена циклина D и протоонкогена MYC, что вызывает стимуляцию клеточной пролиферации.
Е-кадгерин и АРС являются классическими опухолевыми супрессорами - у пациентов с семейными формами соответственно рака желудка и аденоматозного полипоза кишечника в опухолевых клетках наблюдается инактивация обоих аллелей данных генов. Произошедшие еще в половой клетке наследуемые изменения одного из аллелей представляют собой точечные инактивирующие мутации или микроделеции. Второй аллель инактивируется уже в соматической клетке. Подавление активности второго аллеля гена Е-кадхерина нередко связано с его метилированием, а второй аллель гена АРС чаще всего инактивируется в результате делеции участка длинного плеча хромосомы 5, содержащего данный ген, или утраты всей хромосомы 5. Ключевая роль герминальных мутаций APC в генезе аденоматозного полипоза толстой кишки подтверждается тем, что у трансгенных мышей с гомозиготным нокаутом этого гена также развиваются множественные полипы, причем не только в толстом, но и в тонком кишечнике.
Недавно выявлена еще одна важная биологическая функция опухолевого супрессора АРС. Во время митоза он связывается с белками кинетохора и участвует в организации веретена деления. При инактивации APC нарушается взаимодействие микротрубочек с кинетохором, результатом чего является частые ошибки сегрегации хромосом, т.е. нестабильность генома. Это, вероятно, может служить объяснением более частой встречаемости мутаций APC по сравнению с мутациями β-катенина: помимо более эффективного блокирования работы систем деградации β-катенина они ведут также и к генетической нестабильности, что придает клеткам дополнительные селективные преимущества.