Копнин Б.П.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
3.4. Продукты гена INK4a - p16INK4a и pARF - регулируют активность pRb и р53
Следующим после р53 по частоте изменений в различных новообразованиях человека является ген INK4a, расположенный в коротком плече хромосомы 9 (сегмент 9р21). Его исключительной особенностью является одновременное кодирование двух негомологичных ядерных белков - p16INK4a и pARF (продукты альтернативных рамок считывания), каждый из которых выполняет супрессорные функции (Рис. 5).
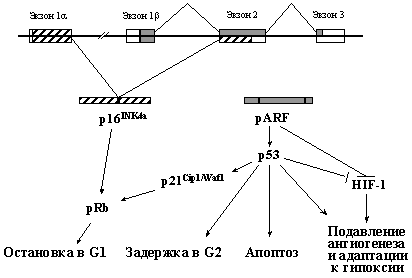
Рис. 5. Ген INK4a кодирует два негомологичных белка, выполняющих разные функции.
p16INK4a связывает циклин-зависимые киназы Cdk4 и Cdk6 и препятствует образованию их функционально активных комплексов с циклинами D, которые, фосфорилируя pRb, инициируют вход в S фазу клеточного цикла. pARF обладает способностью стабилизировать и активировать белок р53, нарушая его взаимодействие с белком Mdm2 (см. раздел 3.3). Кроме того, у него выявлены и р53-независимые функции. Так, он может также непосредственно взаимодействовать с основной мишенью pRb - белком E2F и блокировать его активность. Кроме того, он понижает стабильность транскрипционного фактора HIF-1 (см. 3.3.2 и 3.5.3), связывая его a-субъединицу.
Активность p16INK4a и pARF повышается при экспрессии ряда вирусных (E1A) или клеточных (RAS, RAF, MYC и др.) онкогенов. Такой эффект обусловлен присутствием в гене INK4a респонсивных элементов для транскрипционного фактора E2F, активируемого многими онкогенами. Таким образом, нормальное функционирование продуктов гена INK4a эффективно предотвращает дальнейшее размножение клеток, в которых произошла активация какого-либо из представителей большой группы онкогенов. Кроме того, экспрессия p16INK4a повышается при образовании межклеточных контактов, что обеспечивает контактное торможение размножения клеток.
У трансгенных мышей с гомозиготной нокаутом гена INK4a, вызывающим потерю экспрессии обоих его белковых продуктов, наблюдается высокая частота возникновения в молодом возрасте различных новообразований, преимущественно фибросарком и лимфом (также как у мышей с инактивированным р53). Интересно, что практически такая же картина наблюдается и у мышей с перестройкой гена INK4a, приводящей к потере экспрессии только белка pARF. В отличие от этого у мышей, утративших экспрессию p16INK4a, но сохранивших экспрессию pARF, нет существенного повышения частоты возникновения опухолей (отмечается лишь редкое возникновение меланом, не наблюдаемое в родительских линиях мышей). В культурах in vitro мышиные фибробласты, не экспессирующие оба продукта гена INK4a, как и фибробласты, в которых инактивирован только pARF, легко трансформируются онкогенами семейства RAS. В то же время для Ras-индуцированной трансформации клеток, не экспрессирующих только p16INK4a, необходимо дополнительное действие кооперирующих онкогенов, таких как MYC или E1, подобно тому, как это наблюдается в случае нормальных клеток.
У людей герминальные мутации в одном из двух аллелей гена INK4a ассоциированы с наследственной предрасположенностью к развитию меланом кожи (синдром диспластических невусов). Часть из этих мутаций инактивирует только p16INK4a, не нарушая функцию pARF. В связи с этим предполагается, что синдром диспластических невусов связан с нарушением функции именно p16INK4a. В клетках наследственных и спорадических меланом обнаруживаются изменения обоих аллелей гена INK4a, т.е. данный ген ведет себя как классический опухолевый супрессор. Чаще всего вторая (соматическая) мутация представляет собой делецию гена INK4a, ведущую к инактивации как p16INK4a, так и pARF. Мутации, делеции и метилирование гена INK4a, вызывающие потерю экспрессии одного или обоих его белковых продуктов, часто наблюдаются не только в наследственных и спорадических меланомах, но и в большой группе других ненаследственных новообразований: раке поджелудочной железы, пищевода, желчных путей, мочевого пузыря, Т- и В-клеточных острых лимфолейкозах, мезотелиомах, анапластических астроцитомах, глиобластомах и др.