Копнин Б.П.
НИИ канцерогенеза,
Российский Онкологический научный центр, РАМН,
115478, Москва,
Каширское ш., 24;
факс: (095)324-1739;
электронная почта: kopnin@imb.ac.ru
1. Онкогены и опухолевые супрессоры в регуляции клеточного цикла
В основе образования опухоли лежит избыточное размножение определенных клеток. Совершенно естественно поэтому, что нарушения регуляции клеточного цикла являются неотъемлемым и основополагающим признаком неопластической клетки. "Мотором" клеточного цикла, как известно, служат активности последовательно сменяющих друг друга циклинзависимых киназ [16] (рис. 1). Каждая циклинзависимая киназа (Сdk) представляет собой каталитическую субъединицу холоферментного комплекса, для активности которой требуется присутствие активаторной субъединицы - циклина. Регуляция активности Сdk осуществляется за счет направленного изменения уровня определенных циклинов в определенные фазы клеточного цикла. Кроме того, активность Сdk регулируется изменениями фосфорилирования их определенных аминокислотных остатков. В активной форме комплексы циклин-Cdk фосфорилируют регуляторные белки, контролирующие протекание данной фазы.
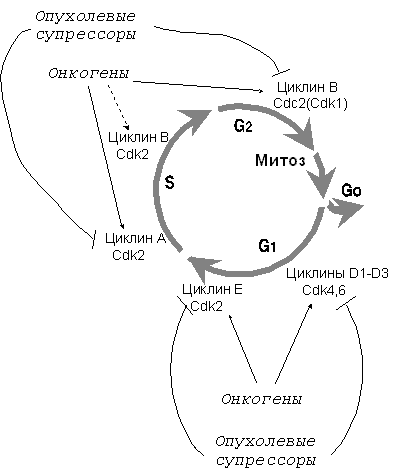
Рис. 1. Движение по клеточному циклу определяется последовательной активацией различных комплексов циклин - Cdk. Большинство из них - мишени активирующего действия онкогенов или ингибирующего действия опухолевых супрессоров
Оказалось, что действие многих протоонкогенов и опухолевых супрессоров направлено на регуляцию тех или иных комплексов циклин - Cdk. Белковые продукты большинства из них повышают активность циклинзависимых киназ, ответственных за начальные этапы пресинтетической фазы G1 (комплексы циклинов D1 - D3 c Сdk4 или Сdk6 в зависимости от типа клеток) и переход из G1 в фазу синтеза ДНК (циклин E - Сdk2) (рис. 1). Кроме того, некоторые протоонкогены и опухолевые супрессоры регулируют активность комплексов циклин А - Сdk2 (требуется для репликации ДНК) и циклин B - Cdk1 (другое название Cdk1 - Cdc2, необходима для перехода из G2 в митоз).
Основным субстратом комплексов циклин D - Cdk4 и циклин D - Cdk6 является опухолевый супрессор pRb и Rb-подобные белки р105 и р130. pRb и его гомологи дефосфорилированы в неделящихся клетках и в пролиферирующих клетках, находящихся в ранней G1-фазе [17]. В таком состоянии они связывают и блокируют транскрипционные комплексы E2F - DP (E2F-1,-2, -3, -4, -5 и DP-1, -2, -3), регулирующие активность ряда генов, продукты которых необходимы для начала и прохождения S-фазы. В частности, E2F-DP регулируют экспрессию генов тимидинкиназы, дигидрофолатредуктазы, циклина Е, циклина А, PCNA, ДНК-полимеразы a и др. [18]. Связывание белков семейства E2F c pRb ингибирует их транскрипционную активность. При митогенных сигналах, вызываемых ростовыми факторами, pRb в середине G1-фазы фосфорилируется комплексом циклин D - Сdk4 (или циклин D - Cdk6), что вызывает высвобождение транскрипционных факторов E2F - DP из комплекса с pRb и их активацию [17]. Одним из следствий этого является стимуляция транскрипции гена циклина Е, в результате чего активируются комплексы циклин Е - Cdk2, также фосфорилирующие pRb. Таким образом, возникает регуляторная петля, поддерживающая активность транскрипционных факторов E2F - DP и контролируемых ими генов, обеспечивающих репликацию ДНК (см. рис.2). После завершения S-фазы pRb переходит в дефосфорилированное состояние, в котором он блокирует активность E2F - DP и вход в следующую S-фазу (для ее инициации необходим новый митогенный стимул, активирующий комплексы циклин D - Cdk4,6). Таким образом, опухолевый супрессор рRb играет ключевую роль в регуляции вхождения клетки в S-фазу.
Продукты многих протоонкогенов являются компонентами сигнальных путей, ответственных за активацию комплексов циклин D - Cdk4(6) и циклин E - Cdk2 в ответ на действие ростовых факторов и/или адгезию клеток к белкам внеклеточного матрикса (рис. 2). Так, связывание рецепторов ростовых факторов со своими лигандами индуцирует димеризацию и аутофосфорилирование рецепторов (одна субъединица димера фосфорилирует другую по тирозинам). Это, в свою очередь, вызывает взаимодействие рецепторных тирозинкиназ со многими сигнальными белками, содержащими SH2-домены и связывающими фосфотирозин. Например, активированные рецепторы фактора роста из тромбоцитов (PDGF-Rb) взаимодействуют с SH2-доменами таких белков, как фосфатидилинозитол-3'-киназа (PI3K), фосфолипаза С (PLC)-g1, латентные формы транскрипционных факторов STAT и адаптерный белок Grb2, передающий сигнал к белкам Ras [19-21]. Связывание каждого из этих белков с фосфотирозинами рецептора вызывает активацию пересекающихся сигнальных путей, завершающуюся активацией в ядре набора транскрипционных факторов и экспрессией специфических генов (рис. 2). В частности, индуцируемый Grb2 переход белков Ras в активированное (GTP-связанное) состояние ведет к стимуляции ряда его эффекторов, в том числе серин-треониновых киназ Raf* и MEKK, запускающих МАР (Mitogen Activated Protein) киназные каскады [20,22]. Конечные продукты этих каскадов, ERK (MAPK), р38 и JNK (SAPK), транслоцируются из цитоплазмы в ядро, где они фосфорилируют и активируют множество субстратов, в том числе такие транскрипционные факторы как, Elk1, Ets1*, Ets2*, Jun*, ATF2, Tcf и др. Это, в свою очередь, вызывает активацию ряда других факторов транскрипции. Так, Elk1, формируя комплекс с SRF (Serum Response Factor), инициирует транскрипцию генов, содержащих в своем промоторе SRE элементы, например гена FOS*.
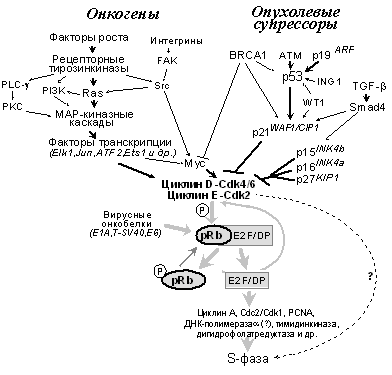
Рис. 2. Продукты многих протоонкогенов и опухолевых супрессоров регулируют активность циклинзависимых киназ, фосфорилирующих pRb. Фосфорилирование pRb, как и его связывание с рядом вирусных онкобелков, вызывает высвобождение и активацию транскрипционных комплексов E2F - DP, повышающих экспрессию генов, продукты которых необходимы для прохождения S-фазы
Сходные реакции наблюдаются и при связывании интегринов (рецепторов, опосредующих адгезию клетки) с белками внеклеточного матрикса. Такое взаимодействие вызывает активацию и аутофосфорилирование киназы FAK (Focal Adhesion Kinase), в результате чего она связывается с SH2-доменом протоонкобелка Src, что, в свою очередь, вызывает рекрутирование адаптерного белка Grb2, активацию Ras и МАР киназных каскадов (рис.2).
Следствием изменений активности ряда транскрипционных факторов, индуцируемых активацией МАР-киназ, является повышение экспрессии гена циклина D1 (предполагается, что за это ответственны белки Jun, Ets1, Ets2 [21]). Кроме того, митогенные сигналы повышают экспрессию Myc, что также вызывает увеличение активности циклинзависимых киназ, оперирующих в G1 (циклин D - Cdk4 и циклин Е - Cdk2). Это связано с тем, что Myc, во-первых, трансактивирует ген Cdc25a - фосфатазы, снимающей ингибиторное фосфорилирование Cdk2 и Cdk4 по Thr-14 и Tyr-15, а во-вторых, понижает экспрессию ингибитора Сdk2, p27KIP1a [23-26]. Механизмы активации Myc при действии ростовых факторов изучены пока плохо. Предполагается, что к ней могут приводить как Ras-независимые сигнальные пути, активируемые онкобелком Src, так и Ras-Raf-MAP-киназные каскады, вызывающие активацию Ets1 и/или E2F (промотор гена MYC содержит респонсивные элементы для этих транскрипционных факторов[22,26]).
Многие участники сигнальных путей, опосредующих в ответ на действие ростовых факторов активацию циклинзависимых киназ и, следовательно, стимуляцию клеточного деления, являются протоонкогенами. Изменения их структуры (мутации), приводящие к ускользанию от воздействия негативных регуляторных факторов и/или перманентному повышению экспрессии, превращают такие протоонкогены в онкогены [1,3,5]. Продукты идентифицированных онкогенов представляют все этажи регуляции митогенного сигнала [5]: ростовые факторы - PDGF-b (Sis), FGF1 и др.; рецепторные тирозинкиназы - EGF-R (ErbB), HGF-R (Met), Ret и др.; белки семейства Ras - K-Ras, H-Ras и N-Ras; эффекторы Ras - серин-треониновые киназы Raf и Mos; транскрипционные факторы - Jun, Ets1, Myc и др.; и, наконец, циклин D1 (Prad1). Складывается впечатление, что при детальном анализе в каждом новообразовании выявляются изменения хотя бы одного из компонентов сигнальных путей (протоонкогенов), вызывающие перманентную стимуляцию активности циклинзависимых киназ и инициацию клеточного деления вне зависимости от действия ростовых факторов.
Интересно, что сигнальный путь Cdk-Rb-E2F контролируется не только pRB, но и многими другими супрессорными белками (рис. 2). Некоторые из них являются ингибиторными субъединицами Cdk (CKIs - Cdk Inhibitors), опосредующими остановку клеточного цикла в ответ на различные внеклеточные и внутриклеточные сигналы [16]. Идентифицировано два семейства CKIs: Ink4 и Cip/Kip. Первое включает четыре представителя, в том числе опухолевые супрессоры p15INK4b и p16INK4a. Белки Ink4 обладают достаточно узкой специфичностью: связывая Cdk4 и Cdk6, они препятствуют образованию их комплексов с циклинами D [16,27]. Семейство Cip/Kip состоит из трех членов: p21WAF1/CIP1, p27KIP1a и p57KIP2. Эти белки связывают и ингибируют уже полностью сформированные комплексы циклин D - Cdk4(6), циклин Е - Cdk2 и циклин А - Cdk2. Кроме того, p21WAF1/CIP1 способен блокировать и комплекс циклин B - Cdc2, ответственный за продвижение по G2-фазе и вход в митоз [16,27]. И p21WAF1/CIP1, и p27KIP1a опосредуют влияние других супрессорных белков. p21WAF1/CIP1 является одной из основных мишеней трансактивационного действия р53, а следовательно, и супрессоров, участвующих в регуляции стабильности/активности р53 (p19ARF, АТМ, WT1 [13,14,28,29] или его транскрипционной активности (BRCA1 и p33ING1 [30-32]). (BRCA1 и WT1 способны активировать p21WAF1/CIP1 также и по неизвестным пока р53-независимым механизмам [31,33]).
Наряду с р15INK4b, p27KIP1a является ключевым компонентом передачи ингибиторных сигналов, индуцируемых связыванием TGF-b со своими рецепторами (Рис. 2). Недавно обнаружено, что активированные рецепторы TGF-b фосфорилируют специфические сигнальные эффекторы, белки Smad2 и Smad3, вызывая их связывание с опухолевым супрессором Smad4. Образующиеся комплексы транслоцируются из цитоплазмы в ядро, где они регулируют транскрипцию специфических генов, в частности ингибиторов Cdk. В результате активируются и p21WAF1/CIP1, и р15INK4b [34-37]. Последний вытесняет p27KIP1a из комплекса с Cdk4/6 и подавляет образование их комплексов с циклинами D, необходимых для продвижения по G1 (рис. 1). Высвобожденный p27KIP1a, в свою очередь, связывает и ингибирует комплексы циклин Е - Сdk2, ответственные за начало S-фазы. Повышение экспрессии p21WAF1/CIP1 также ведет к подавлению активности комплексов циклин D - Cdk4,6 и циклин E - Cdk2. В результате клетка останавливается в G0/G1 и не входит в S-фазу (рис. 3).
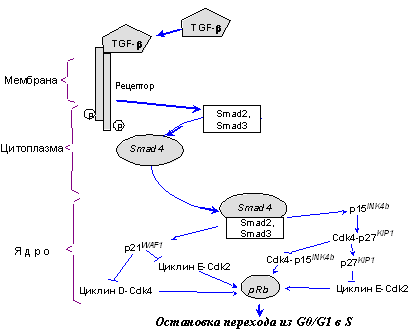
Рис. 3. Cвязывание TGF-b со своим рецептором вызывает образование транскрипционных комплексов Smad4 - Smad2,3, которые транслоцируются из цитоплазмы в ядро. Это приводит к активации ряда мишеней, в том числе и ингибиторов циклинзависимых киназ p21WAF1/CIP1, p15INK4b, p27KIP1a, что вызывает подавление активности Cdk4,6 и Cdk2, ответственных за продвижение по G1 и вход в S-фазу (объяснения в тексте)
Ингибирующий эффект TGF-b преодолевается гиперэкспрессией онкогенов MYC или MDM2 [38]. И если действие Myc связано с активацией различных Cdk путем повышения экспрессии Cdc25A [23] и стимуляции деградации p27KIP1a [24], то белок Mdm2 помимо деградации р53 [13,14] вызывает и инактивацию pRb [39], высвобождая таким образом активные транскрипционные комплексы E2F - DP. Следовательно, и гиперэкспрессия протоонкогенов MYC или MDM2, и инактивирующие мутации в опухолевых супрессорах Smad4, p15INK4b, pRb имеют одно общее последствие - клетки ускользают от ингибирующего действия TGF-b, что представляется очень важным для развития эпителиальных опухолей, в частности раков кишечника и поджелудочной железы [40,41].
Одним из наиболее ярких достижений двух последних лет явилась идентификация еще одного важнейшего сигнального пути, очень часто нарушающегося в различных новообразованиях человека и осуществляющего, вероятно, регуляцию клеточного цикла в зависимости от состояния мембранных и подмембранных структур клетки [42] (см. рис. 4). Оказалось, что в несвязанном с E-кадхерином состоянии b-катенин может функционировать как фактор транскрипции. В цитоплазме он связывается с другим транскрипционным фактором Tcf4, после чего комплексы b-катенин - Tcf4 транслоцируются в ядро и активируют гены, имеющие в своем составе специфические респонсивные элементы. Одними из основных мишеней трансактивационного действия комплекса b-катенин - Tcf4 является гены циклина D1 [43] и MYC [44]. Опухолевый супрессор APC, врожденные мутации которого вызывают развитие аденоматозного полипоза кишечника, связывает свободный цитоплазматический b-катенин, что вызывает деградацию последнего [45,46]. Таким образом, инактивация АРС стимулируя образование комплексов b-катенин - Tcf4, повышает транскрипцию генов циклина D1, MYC и, как следствие, ведет к активации циклинзависимых киназ, ответственных за продвижение по G1 и вход в S фазу (рис. 4). К таким же последствиям приводит и мутации b-катенина, увеличивающие стабильность его в цитоплазме (такие мутации обнаруживаются у пациентов с семейным полипозом, не имеющих мутаций APC [43,47]; большинство из них поражает сайты b-катенина, фосфорилируемые гликогенсинтетазой-киназой-3b, GSK-3b). Сходная картина наблюдается также и при активации протоонкогена WNT1 (Wingless/INT1) (рис 4). Связывание его продукта Wnt1 (член семейства цистеин-богатых гликозилированных сигнальных протеинов) со своим рецептором (Frizzled) вызывает перемещение цитоплазматического белка Dsh к мембране, где он ингибирует киназную активность GSK-3b, которая, фосфорилируя b-катенин и APС, стимулирует их связывание и деградацию b-катенина. Таким образом, индуцируемое Wnt1 подавление активности GSK-3b приводит к стабилизации и повышению внутриклеточной концетрации цитоплазматического b-катенина, что повышает вероятность образования активных транскрипционных комплексов b-катенина с факторами семейства Tcf/Lef1 [48]. Не исключено, что мутации в гене Е-кадхерина также могут быть ответственны за стимуляцию сигнальных путей, опосредуемых транскрипционными активностями b-катенина.
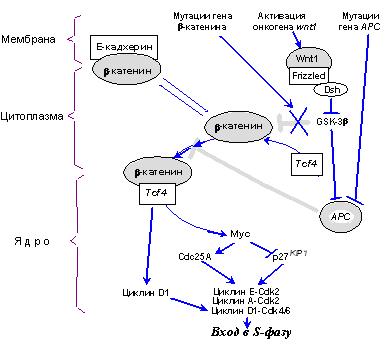
Рис. 4. Мутации опухолевых супрессоров АРС и b-катенина, как и активация онкогена wnt1, стимулируют образование транскрипционных комплексов b-катенин - Tcf4, регулирующих гены MYC и циклина D1. В результате повышается активность ряда комплексов циклин - Cdk (объяснения в тексте)
Подводя итоги этого раздела, заметим, что большинство известных протоонкогенов и опухолевых супрессоров тем или иным образом регулируют активность циклинзависимых киназ, ответственных за вход в S-фазу клеточного цикла. Продукты некоторых из клеточных (Mdm2) или вирусных (Т-антиген вируса SV40, E1A аденовирусов, E7 HPV и др.) онкогенов связывают и инактивируют основной субстрат таких Cdk - pRb. По-видимому, нарушения в сигнальных путях > Cdk2,4/6 > pRb > E2F/DP являются необходимыми для появления постоянно пролиферирующих неопластических клеток.