М.Б. Бычков, В.А. Горбунова, Д.Р. Насхлеташвили, З.П. Михина
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Метастазы в головной мозг – серьезное осложнение опухолевого процесса, которое отмечается у 12–20% онкологических больных. В структуре метастатического поражения головного мозга первое место занимает рак легкого (48%), далее следуют рак молочной железы (15%), меланома (9%), рак толстой кишки (5%), рак почки (4%). Метастазы в мозг сарком, семином и других опухолей бывают реже (Alfred Yung W.K., 2003 г.).
По числу больных, у которых выявлены метастазы в головной мозг, рак легкого (РЛ) у мужчин и рак молочной железы (РМЖ) у женщин занимают ведущее место (7, 17). Метастазы в головной мозг обнаруживаются на аутопсии у 25% больных, умерших от злокачественных новообразований. Прижизненно поражение головного мозга диагностируется примерно в 1,5–3 раза реже по сравнению с находками на вскрытии (7, 8, 23).
Обычно метастазы в мозг развиваются в течение от 6 месяцев до 2 лет после выявления первичной опухоли и ассоциируются с прогрессированием болезни. Метастазы в мозг могут проявляться в любое время заболевания раком, чаще возникают метахронно, но могут проявляться синхронно или даже до выявления первичной опухоли. Внутримозговые метастазы в 10–22% могут быть первым проявлением заболевания либо обнаруживаться во время лечения. Однако в наибольшей степени сроки их выявления зависят от биологических особенностей первичной опухоли. Так, при мелкоклеточном раке легкого (МРЛ) метастазы в головном мозге обнаруживаются в большинстве случаев (50–80%) в течение первого–второго года заболевания, а при РМЖ – в более отдаленные сроки – от 3–4 до 15 лет и более (8, 13, 19). По данным некоторых исследований неблагоприятным прогностическим фактором для больных раком молочной железы, указывающим на повышенный риск метастазирования в головной мозг, является гиперэкспрессия HER2/neu в первичной опухоли (11, 16, 17).
В последние годы отмечается рост числа больных с метастазами в головной мозг. При этом увеличение частоты клинически проявляемых метастазов связано как с совершенствованием диагностики за счет внедрения в клиническую практику рентгеновской компьютерной (РКТ) и магнитно-резонансной томографии (МРТ), так и с увеличением продолжительности ремиссий вследствие использования более эффективных современных программ лечения.
Метастазы в мозг всегда гематогенные, они продуцируют и секретируют ангиогенные субстанции, что делает их васкуляризируемыми и позволяет опухолевым клеткам легче проникать через гематоэнцефалический барьер (ГЭБ). Симптомы метастатического поражения головного мозга обычно развиваются в течение нескольких недель и зависят от размеров, числа и локализации метастазов.
Ранее считалось, что только жирорастворимые препараты могут проникать в головной мозг, однако в исследовании Vick с соавт. (1977 г.) было показано, что функция ГЭБ сильно различается при наличии поражения головного мозга по сравнению с нормальным, и он перестает выполнять «барьерную» функцию в присутствии опухоли.
Hasagawa с соавт. (1979 г.) отметили, что жирорастворимость не является обязательным условием проникновения препарата в ткани мозга и, что водорастворимые лекарственные вещества, такие как метотрексат, циклофосфан и цисплатин способны проникать в опухолевые клетки после их парентерального введения.
В настоящее время считается, что ГЭБ играет важную роль у больных с метастазами в мозг, но его защитные свойства ограничены нормальной тканью мозга, а не самим метастазом. Приводятся данные о том, что нарушение функции ГЭБ наступает уже при размерах метастаза около 1 мм (1, 21, 23).
На основании полученных результатов лечения метастатических опухолей головного мозга определены факторы, при которых лекарственное лечение может быть эффективным. Прежде всего это чувствительность первичной опухоли к системной химиотерапии (наилучшие результаты получены у больных МРЛ и РМЖ); супратенториальное расположение метастазов (лечение метастазов в задней черепной ямки оказалось менее эффективным по сравнению с другими областями мозга); множественные мелкоочаговые метастазы. Благоприятными признаками также являются отсутствие других отдаленных метастазов и длительный интервал между диагностикой первичной опухоли и метастазами в мозг (больные с более коротким интервалом имеют худший прогноз).
Выбор метода лечения (операция, лучевая терапия, химиотерапия) зависит от распространенности опухолевого процесса, морфологической характеристики опухоли, возраста больных и общего состояния.
По данным различных исследований, медиана продолжительности жизни больных с метастазами в мозг составляет без лечения 1-2 месяца, у получающих кортикостероиды – 2-3 месяца, у получавших лучевую терапию (ЛТ) – 3-6 месяцев, у подвергнутых оперативному лечению и последующему облучению мозга – 10-16 месяцев, у получающих химиотерапию (при чувствительных к химиотерапии нозологических формах) – 8-12 месяцев (Wen P.Y. et al., 2001 г.).
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в течение длительного периода времени проводятся исследования по изучению эффективности различных схем химиотерапии у больных с метастатическим поражением головного мозга.
Схема AVP впервые разработана в отделении химиотерапии, где проводилось изучение её эффективности при метастазах в головной мозг МРЛ (2, 3, 4, 6, 10, 12).
Режим AVP следующий:
Из 29 оцененных по данным РКТ больных, получавших лечение по вышеуказанной схеме, полная регрессия в головном мозге достигнута у 15 (52,0%), частичная – у 3 (10,3%), а стабилизация или прогрессирование – у 10 (37,7%) пациентов. Полная регрессия при применении схемы AVP наблюдалась у 7 больных после первого курса химиотерапии, у 7 больных – после второго курса, у 1 – после четырех. Всего у 15 больных с полной регрессией проведен 51 курс, в среднем - 3,4 курса на больного. У оцененных больных полная ремиссия сохранялась от 3 до 78 месяцев (медиана – 5,5 мес.). При возобновлении роста метастазов у 7 больных им проводилось повторное лечение другими схемами химиотерапии, осуществлялась лучевая или химиолучевая терапия.
Медиана продолжительности жизни больных с объективным эффектом составила 9,4±1,4 месяцев по сравнению с 7,0±0,7 месяцев у пациентов со стабилизацией или прогрессированием метастазов в головном мозге. Около 40% больных прожили год и 27% – два года в группе AVP при достижении объективного эффекта со стороны внутримозговых метастазов; и все больные при отсутствии эффекта прожили менее 10 месяцев (рис. 1).
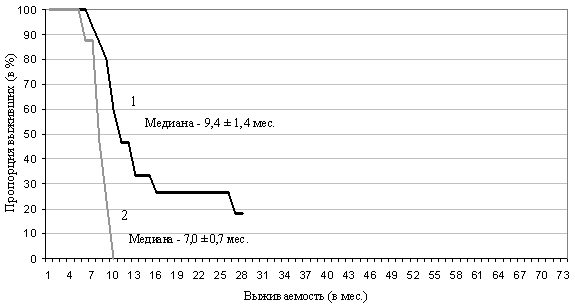
При сравнении AVP и других схем (CAV, AC и др.) отмечались достоверно лучшие показатели как по полным (52,0% и 12%), так и по объективным ответам в головном мозге (62,3% и 24%) при использовании AVP (p=0,0035 и 0,0067, соответственно).
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России в настоящее время проводится изучение других режимов химиотерапии при метастазах МРЛ в головной мозг.
Так, продолжается изучение комбинации ArDV (араноза + доксорубицин + винкристин) во 2-й линии лечения больных распространенным МРЛ. Лечение проводится по схеме: араноза 1000 мг в/в в 1 и 2 дни, доксорубицин 40 мг/м² в/в в 1-й день, винкристин 2 мг в/в в 1-й день 21-дневного цикла. При использовании данного режима химиотерапии у 10 больных МРЛ с метастазами в головной мозг, получавших ранее химиотерапию, у 3-х пациентов достигнута полная регрессия в мозге, у 1 – частичная регрессия.
Таблица 1.
Эффективность режима ArDV (араноза + доксорубицин + винкристин) во II линии химиотерапии больных МРЛ с метастазами в головной мозг (данные отделения химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России).
| Количество больных | Полная регрессия | Частичная регрессия | Стабилизация | Прогрессирование |
|---|---|---|---|---|
| 10(100%) | 3(30%) | 1(10%) | 4(40%) | 2(20%) |
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России продолжается изучение комбинированной химиотерапии по схеме: кампто 60 мг/м² внутривенно в 1, 8 дни + цисплатин 80 мг/м² внутривенно в 1 день у больных распространенной формой МРЛ в качестве I линии лечения. При оценке эффекта химиотерапии метастазов в головной мозг (по данным РКТ головного мозга с внутривенным контрастированием) у 3 из 10 больных (30%) зарегистрирована частичная регрессия опухоли, у 2 (20%) – полная регрессия метастазов в мозг (9).
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России изучалась эффективность различных схем химиотерапии у больных с метастазами РМЖ в головной мозг (6). При химиотерапии метастазов РМЖ в головной мозг у 34 пациенток объективный эффект (полная + частичная ремиссия) достигнут у 18 (52,9%) больных. В зависимости от различных схем химиотерапии эффективность составила 30-62%, в том числе, при применении схем с антрациклинами (CAF, AC, FEC) у 13 больных объективный эффект в мозге зарегистрирован у 8 (62%) пациенток (у 1 - полная регрессия, у 7 – частичная регрессия).
В последние годы в мире проводится ряд клинических исследований по изучению эффективности новых схем химиотерапии у больных немелкоклеточным раком легкого (НМРЛ) с метастатическим поражением головного мозга.
Quadvlieg V. c соавт. (2004 г.) показали высокую эффективность схемы химиотерапии: гемцитабин 1000 мг/м² внутривенно в 1 и 8 дни + цисплатин 50 мг/м² внутривенно в 1 и 8 дни (20). Курсы химиотерапии проводились каждые 3-4 недели. В целом, при лечении были достигнуты 9 полных регрессий в головном мозге (25%) и 14 частичных регрессий (39%). Таким образом, общий эффект составил 64% (23 из 36 больных). Медиана продолжительности эффекта составила 6,8 мес.
На основании этих данных в отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России начато изучение эффективности гемцитабина в сочетании с цисплатином у больных с метастазами НМРЛ в головной мозг. Схема лечения: гемцитабин 1000 мг/м² в/в в 1 и 8 дни + цисплатин 50 мг/м² в/в в 1 и 8 дни. Курсы химиотерапии - каждые 28 дней. Оценка эффекта – каждые 2 курса химиотерапии. Эффект в головном мозге (РКТ/МРТ) оценен у 7 больных. Достигнуто 5 частичных регрессий метастазов в головной мозг и 2 стабилизации.
К препаратам, открывающим новые возможности в лечении метастазов злокачественных опухолей в головной мозг, относится темозоломид (темодал), алкилирующий препарат II поколения, принадлежащий к классу имидазотетразинов (5, 9). Темодал был синтезирован в 1984 году, он обладает высокой проницаемостью через ГЭБ, имеет низкую гематологическую токсичность. Темодал обладает 100% биодоступностью при приеме внутрь и быстрой полной всасываемостью в кишечнике. Темодал назначается в следующем режиме: 200 мг/м²/день 5 дней (курсы - каждые 28 дней) для нелеченных взрослых пациентов и детей, и 150 мг/м²/день 5 дней (курсы - каждые 28 дней) для пациентов, получавших предшествующую химиотерапию (в случае отсутствия миелосупрессии 3 и 4 степени доза темодала при последующих курсах может быть увеличена до 200 мг/м²/день).
В настоящее время проводятся исследования по изучению эффективности темодала при метастазах в головной мозг в монохимиотерапии, в сочетании с лучевой терапией, а также в составе лекарственных комбинаций (15).
В отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России проведено исследование по изучению эффективности химиотерапии темодалом у больных с метастазами злокачественных опухолей в головной мозг. Схема лечения: темодал 150-200 мг/м²/день, 5 дней (курсы - каждые 28 дней) до 6 курсов. Оценка эффекта – каждые 2 курса химиотерапии. В исследование включены 15 больных. Эффект оценен у 11 больных (РМЖ - 1 больная, НМРЛ рак легкого - 7 больных, меланома - 3 больных). Достигнута 1 полная регрессия метастазов в мозг у больного меланомой (9%), 3 длительные стабилизации (>6 мес.) у больных НМРЛ (27%), у 7 больных (64%) – прогрессирование болезни (табл. 2). Медиана продолжительности жизни составила 5,0 мес.
Таблица 2.
Темодал при метастазах злокачественных опухолей в мозг (данные отделения химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России).
| Количество больных | Полная регрессия | Частичная регрессия | Стабилизация | Прогрессирование | |
|---|---|---|---|---|---|
| НМРЛ | 7 | - | - | 3 | 4 |
| РМЖ | 1 | - | - | - | 1 |
| Меланома | 3 | 1 | - | - | 2 |
| Всего | 11 (100%) | 1 (9%) | - | 3 (27%) | 7 (64%) |
Предварительные исследования показывают, что темодал в сочетании с ЛТ увеличивает эффективность лечения метастазов в головной мозг у больных с солидными опухолями на 20-30% в сравнении с одной ЛТ (5).Данные мультицентрового исследования выживаемости больных с метастазами НМРЛ в мозг, получавших лечение темодалом в комбинации с ЛТ по сравнению с одной ЛТ показаны в таблице 3.
Таблица 3.
Выживаемость больных с метастазами НМРЛ в мозг, получавших лечение темодалом в комбинации с лучевой ЛТ по сравнению с ЛТ в самостоятельном варианте.
| Число больных | Объективный ответ | Медиана продолжительности жизни | |
|---|---|---|---|
| Темодал + ЛТ | 52 | 48% (p=0.031) | 7,9 мес. (p=0.06) |
| ЛТ | 51 | 27,5% | 4,3 мес. |
| Всего: | 103 | - | - |
В ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России так же изучается эффективность химиолучевой терапии по схеме: темодал в сочетании с ЛТ при лечении метастатических опухолей головного мозга (5, 15). Схема лечения: темодал 75 мг/м² внутрь 1-14 дни + ЛТ на область головного мозга (РОД=3 Гр, СОД=30 Гр). В исследование включены 30 больных. Эффект оценен у 21 больного (2 больных МРЛ, 10 больных НМРЛ, 5 больных меланомой и 4 больных РМЖ). Объективный эффект достигнут у 14 больных (66,6%). Достигнуты 5 полных регрессий метастазов в головной мозг (1 – у больного МРЛ, 2 – у больных НМРЛ, 1 – при меланоме, 1 – у больной РМЖ), 9 частичных регрессий (1 - у больного МРЛ, 5 – у больных НМРЛ и 3 – при РМЖ) и 6 стабилизаций (1 – у больной РМЖ, 2 – у больных меланомой и 3 – у больных НМРЛ). Медиана продолжительности жизни составила 8,0 мес. Результаты исследования представлены в таблице 4.
Таблица 4.
Темодал + лучевая терапия у больных с метастазами в головной мозг (данные ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России).
| Число больных | Полная регрессия | Частичная регрессия | Стабилизация | Прогрессирование | |
|---|---|---|---|---|---|
| МРЛ | 2 | 1 | 1 | - | - |
| НМРЛ | 10 | 2 | 5 | 3 | - |
| РМЖ | 5 | 1 | 3 | 1 | - |
| Меланома | 4 | 1 | - | 2 | 1 |
| Всего | 21 (100%) | 5 (23,8%) | 9 (42,8%) | 6(28,6%) | 1 (4,8%) |
В настоящее время продолжаются исследования по изучению сочетания новых противоопухолевых препаратов (кампто, топотекан) с ЛТ при лечении больных с метастатическим поражением мозга.
В последние годы проводятся исследования по изучению эффективности таргетных препаратов у больных с метастазами в головной мозг. Как показали предклинические исследования, отмечается гиперэкспрессия рецепторов эпидермального фактора роста в опухолевой ткани при метастатическом поражении головного мозга и первичных опухолях мозга.
Основываясь на этих данных, Giovanni L.С. с соавт. (2004 г.) изучали эффективность препарата ZD1839 (иресса) у больных НМРЛ с метастазами в головной мозг. В исследование были включены 35 больных НМРЛ (26 мужчин и 9 женщин). 28 больных ранее получали цисплатин-содержащие схемы химиотерапии, 16 проводилась ЛТ на область головного мозга. Схема лечения: иресса 250 мг/сутки внутрь, до прогрессирования болезни. У 5 (17%) больных была достигнута частичная регрессия, у 7 – стабилизация (24%). Таким образом, контроль роста опухоли был отмечен у 12 (41%) пациентов. Результаты данного исследования показывают, что Иресса эффективна у больных с метастазами НМРЛ в головной мозг, получавших ранее лечение (химио- и лучевую терапию).
Таким образом, результаты исследований по лечению больных с метастатическим поражением головного мозга показывают, что:
Список литературы:
1. Бредбери М. Концепция гематоэнцефалического барьера. М., «Медицина», 1983, с. 480.
2. Бычков М.Б., Горбунова В.А., Орел Н.Ф., Егоров Г.Н., Насхлеташвили Д.Р. Лекарственная терапия метастазов в головной мозг. Вестник Московского Онкологического Общества, 2004 г., №1 (504).
3. Бычков М.Б., Орел Н.Ф.. Насхлеташвили Д.Р., Современные возможности лечения мелкоклеточного рака легкого. - Вопросы онкологии, том 47, №6, 2001, стр.757-761.
4. Бычков М.Б., Орел Н.Ф., Насхлеташвили Д.Р. Современные возможности лекарственного лечения мелкоклеточного рака легкого. В кн.: Этюды химиотерапии. М., 2000, с. 70–74.
5. Горбунова В.А. Темодал - новые возможности и перспективы лечения опухолей головного мозга. Фарматека 2004, №18, 15–20.
6. Горбунова В.А., Бычков М.Б., Михина З.П., Войнаревич А.О., Насхлеташвили Д.Р. Химиотерапия больных раком молочной железы с метастазами в головной мозг. Материалы III съезда онкологов и радиологов СНГ 25-28.05.2004 г., часть II, стр. 256-257.
7. Идрисова М.И. Поражение головного мозга при раке легкого. Дисс. канд. мед. наук, М., 1980, 212 стр.
8. Моисеенко В.М., Семиглазов В.Ф., Тюляндин С.А. Современное лекарственное лечение местно-распространенного и метастатического рака молочной железы. «Грифон», Санкт-Петербург, 1997, с. 254.
9. Насхлеташвили Д. Р. Кампто (Иринотекан) в лечении первичных и метастатических опухолей головного мозга. Журнал “Врач”, 2005 г., №12, стр. 67-69.
10. Орел Н.Ф. Новые производные нитрозомочевины. В книге.: Новые цитостатики в лечении злокачественных опухолей, М., 1998, с. 25–39.
11. Altaha R., Crowell E., Ducatman B., Higa G., Abraham J.; West Virginia University, Morgantown, WV. Risk of brain metastases in HER2/neu-positive breast cancer. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 682.
12. Bychkov M.B.,. Gorbounova V.A,. Marenich A.F, Voinarevich A.O. D.R. Naskhletashvili Combined chemotherapy with AVP (Nidran + Vepesid + Cisplatin) in patients with extensive lung cancer. – Lung cancer. Vol. 29, Supplement 1, 2000, p. 37-38.
13. Fisher B., Osborne C.K., Margolese R.G. Bloomer W.D. Neoplasms of the breast. In: Cancer medicine, vol. 2, 4th ed. Holland J.F., Bast R.C. Morton D.L., Frei III E., Kufe D.W., Weichselbaum R.R. Williams & Wilkins. Baltimore, Philadelphia, London, Paris, Bangkok, Buenos Aires, Hong Kong, Munich, Sydney, Tokyo, Wroclaw, 1997, p. 2349–2429.
14. French L.A., Galicich J.H. The use of steroid for control of cerebral edema. Clin. Neurosurg., 1964, 10, p. 212–223.
15. Gorbounova V.A., Bychkov M.B., Michina Z.P., Naskhletashvili D.R., Tеmozolomide in patients with brain metastases. 16th International Congress of Anti-Cancer Treatment (01-04/02/2005 г., Paris, France). Abstract book, p. 306.
16. Heimberger, et al. Cl. Cancer Res., 2002; 8: 3496-3502.
17. Herrero A., Grandez R., Puertolas T., Alonso Orduna V., Martinez Trufero J., Pazo Cid R., Artal A., Lao J., Ruiz de Lobera A., Anton Torres A.; Hospital Miguel Servet, Zaragoza, Spain. High incidence of brain metastases at the time of death in women with metastatic breast cancer treated with trastuzumab. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 765.
18. Lai R.K., Dang C., Thaler H., Malkin M.G. The incidence of brain metastases in HER2/neu+ stage IV breast cancer patients. ASCO, 2001, abstract 2014.
19. Nieder C., Niewald M., Hagen T. Brain metastases of bronchial and breast carcinoma. Differences in metastatic behavior and prognosis. Radiologie, 1995, 35, 11, p. 816–821.
20. V. Quadvlieg, L. Bosquee, M. Gustin, N. Barthelemy; CHU LIEGE, LIEGE, Belgium; CHR Citadelle LIEGE, LIEGE, Belgium. Frontline gemcitabine and cisplatin based chemotherapy in patients with NSCLC inoperable brain metastases. Journal of Clinical Oncology, 2004 ASCO Annual Meeting Proceedings (Post-Meeting Edition). Vol 22, No 14S (July 15 Supplement), 2004: 7117.
21. Qin D., Ma J., Xiao J., Tang Z. Effect of brain irradiation on blood-CSF barrier permeability of chemotherapeutic agents. Am. J. Clin. Oncol. Cancer Clin. Trials., 1997, 20, 3, p. 263–265.
22. Vecht C.J. Clinical management of brain metastasis. J. Neurol, 1998, 245, 3, p. 127–131.
23. Zhang M., Olsson Y. Hematogenous metastases of the human brain - Characteristics of peritumoral brain changes: A review. J. Neuro. Oncol., 1997, 35, 1, p. 81–89.