ФАКТОРЫ ПРОГНОЗА ПРИ ДИФФУЗНОЙ КРУПНОКЛЕТОЧНОЙ В-КЛЕТОЧНОЙ ЛИМФОМЕ
И.В. Поддубная, Л.Г. Бабичева
Кафедра онкологии РМАПО, Москва
В последние годы заболеваемость неходжкинскими лимфомами (НХЛ) имеет неизменную тенденцию к росту; она выше в развитых странах, где за последние 20 лет увеличилась более чем на 50% и по темпу прироста превышает лимфогранулематоз. Наиболее часто встречающимся вариантом агрессивных НХЛ является диффузная крупноклеточная В-клеточная лимфома (ДККЛ), течение которой характеризуется склонностью к быстрой генерализации опухолевого роста, что определяет крайне неблагоприятный прогноз и высокую летальность больных: 5-летняя выживаемость составляет в среднем 38%, а медиана выживаемости не леченных больных не превышает 1 года (Gaynor E.R., 1998).
Разработанные в последние годы программы лечения позволили увеличить продолжительность ремиссии и жизни, но не решили проблему полного излечения больных. Повышение интенсивности терапевтических программ способствует увеличению эффективности, с одной стороны, но и развитию тяжелых осложнений на фоне миелосупрессии – с другой, и поэтому является оправданной не во всех случаях. Остаются мало разработанными критерии выбора оптимального объема и длительности лечения в каждом конкретном случае. Важным этапом решения проблемы индивидуализации лечебных программ является оценка прогностического значения ряда клинико-лабораторных характеристик заболевания у каждого больного до начала специфической терапии.
В области изучения НХЛ основное внимание уделяется прогностической ценности различных морфологических вариантов заболевания, при этом диффузная крупноклеточная В-клеточная лимфома определяется как наиболее неблагоприятный.
Не вызывает сомнений прогностическое значение клинической стадии заболевания. Результаты всех исследований отчетливо указывают на более низкую продолжительность жизни больных с III-IV стадиями в сравнении с I-II. Доказана зависимость прогноза течения лимфомы от возраста, наличия экстранодальных очагов, общего состояния больного и содержания сывороточной лактатдегидрогеназы (ЛДГ). Эти факторы легли в основу Международного прогностического индекса (МПИ). Недостаточно изученными остаются вопросы прогностической ценности симптомов интоксикации, исходного уровня гемоглобина, общего белка и альбуминов, большой опухолевой массы и т.д. Литературные сведения по этим вопросам неоднозначны и противоречивы.
В наше ретроспективное не рандомизированное исследование включены 136 больных диффузной крупноклеточной В-клеточной лимфомой, установленной в соответствие с классификацией REAL (1994 г.) и ВОЗ (2001 г.) на основании иммуноморфологического исследования опухолевой ткани. Пациенты получали лечение и наблюдались в РОНЦ с января 1995 г. по январь 2003 г.
Мужчин было 51% и женщин - 49%. Возраст больных варьировал от 14 до 87 лет, составляя в среднем 50,76±1,62 года; 54 (40%) пациента были старше 60 лет.
Определение стадии заболевания осуществлялось с помощью клинической классификации для злокачественных лимфом, предложенной в Анн-Арбор в 1971 г. I стадия заболевания была диагностирована у 10 (7,5%) больных, II стадия – у 36 (26,5%), III стадия – у 11 (8%) больных, а IV стадия – у 79 (58%) пациентов (рис. 1). Таким образом, к моменту постановки диагноза генерализованную стадию заболевания имели более половины (66%) больных.
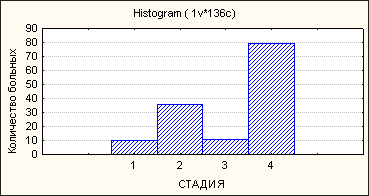
Рис. 1. Распределение больных по стадиям.
Экстранодальные проявления лимфомы были выявлены у 115 (84,5%) больных, причем поражение более одной экстранодальной зоны изначально было обнаружено у 47 (34,6%) пациентов. Общее состояние 50 (37%) больных расценивалось как тяжелое, соответствующее 3-4 степени по шкале ECOG. Повышение уровня ЛДГ выше нормы отмечалось у 87 (64%) пациентов, причем в 31 (23%) случае уровень этого фермента составил более двух норм (?900 Ед/л). Следует отметить, что высокий уровень ЛДГ (>750 Ед./л) достоверно чаще регистрировался у больных моложе 60 лет (р=0,042).
Таким образом, в соответствии с МПИ, пациенты распределились следующим образом: к низкой степени риска раннего прогрессирования (0-1 фактор) были отнесены 37 (27%) больных, к промежуточной низкой (2 фактора) – 35 (26%) больных, в группу промежуточной высокой степени (3 фактора) вошел 31 (23%) больной, а высокой степени (4-5 факторов) - 33 (24%)больных. Следовательно, около половины пациентов (47%) были отнесены в неблагоприятную прогностическую группу (рис. 2).
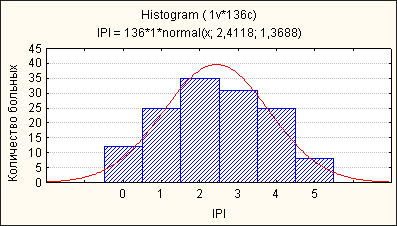
Рис. 2. Распределение больных по количеству неблагоприятных факторов по МПИ.
Кроме основных факторов, входящих в МПИ, были отмечены симптомы интоксикации (В-симптомы), включающие снижение массы тела на 10% и более в течение 6 мес., наличие лихорадки (>38?С) в течение не менее 3 дней подряд без признаков воспалительного процесса и ночная профузная потливость. Они сопровождали заболевание в 29 (21%) случаях. Следует отметить, что частота этого признака была прямо пропорциональна количеству неблагоприятных факторов по МПИ.
В настоящее время массивным поражением (“bulky”) принято считать опухолевые образования диаметром более 10 см. К моменту постановки диагноза первичная опухоль достигала больших (более 10 см) размеров в 86 (63%) случаях, причем у 29 (21,3%) больных это было массивное поражение лимфоузлов средостения. Отмечена высоко достоверная зависимость этого признака от количества неблагоприятных факторов МПИ. Так, в группе низкого риска наличие “bulky “ зарегистрировано у 49% больных, а в группе высокого риска по МПИ– у 94% больных (р=0,001).
Снижение уровня общего белка сыворотки крови ниже нормы (минимальное значение составило 53,5 г/л) отмечалось у 15 (11%) пациентов. Уровень альбумина сыворотки крови ниже 35 г/л (до 26,1 г/л) зарегистрирован у 14 (10%) больных. Анемия (гемоглобин<120 г/л) выявлена в 58 (42%) случаях, причем у 14 (10%) больных уровень гемоглобина был ниже 100 г/л.
Необходимо отметить такой показатель как общее количество зон поражения: у 82 (60%) пациентов к моменту постановки диагноза было выявлено менее 4 зон поражения; в 28 (21%) случаях их было от 4 до 7; более 7 зон поражения изначально было диагностировано у 26 (19%) больных.
В общей сложности 90 (66%) пациентов на момент поступления в клинику имели генерализованную (III-IV) стадию заболевания с наличием симптомов интоксикации в 29 (21%) случаях и биологической активности в 87 (64%) случаях. Только у 46 (34%) больных лимфома была распознана в локальных (I-II) стадиях. Среди причин позднего поступления больных в специализированное отделение можно назвать низкую специфичность начальных симптомов болезни, трудность диагностики основных локализаций в ранней стадии, выраженную агрессивность опухолевого роста и недостаточную онкологическую настороженность населения и врачей общей практики.
Все больные получали антрациклинсодержащие режимы химиотерапии. Полная программа лечения (6-8 курсов) проведена 65% больным, среднее количество курсов на одного человека составило 5. Стандартную схему СНОР (циклофосфан, адриамицин, винкристин, преднизолон) получили 67,7% пациентов.
При анализе результатов лечения была использована современная классификация оценки эффективности терапии при НХЛ, разработанная Международной Рабочей группой (B. Cheson, 1999). Согласно этой классификации, в результате индукционной терапии полная ремиссия была достигнута в 85 (62%) случаях, частичная ремиссия получена у 23 (17%) больных.
Нами выявлена высоко значимая обратная зависимость распространенности заболевания и частоты полных ремиссий, которая постепенно уменьшается со 100% при I стадии до 47% при IV стадии НХЛ (р=0,001). Частичная ремиссия также оказалась в прямой зависимости от стадии лимфомы, и ее частота увеличивалась от 0% при I стадии до 24% при IV.
Из 85 пациентов, достигших полной ремиссии, более чем у 1/3 больных (37,6%) отмечено развитие рецидива лимфомы в различные сроки. Наибольшая частота появления рецидива (26 случаев - 81%) зарегистрирована в течение первого года наблюдения, причем в подавляющем большинстве случаев (21 случай - 80%) в первые 6 мес. Всего у 5 (13,5%) больных рецидив был выявлен позже 24 мес. наблюдения, и только в 1 (2,7%) случае рецидив возник в течение второго года заболевания.
Среди 23 больных с частичной ремиссией у 5 (22%) пациентов выявлены рецидивы НХЛ, причем, во всех случаях – в первые 6 мес. наблюдения.
Из 37 пациентов с возвратом заболевания лишь 4 (11%) ответили на II линию лечения: в 2 случаях ранних рецидивов проводилась химиотерапия по схеме ВАЕМ, а у 2 пациентов с поздними рецидивами было повторено предыдущее лечение: в одном случае - по схеме СНОР, в другом – CIOP.
Прогрессирование заболевания на фоне лечения отмечено у 27 (20%) больных: в 4 (11%) случаях в группе со II стадией НХЛ против 23 (29%) больных с IV стадией лимфомы; разница статистически значима (р=0,005). Ни один из этих пациентов не ответил на последующие виды лечения. У 17 из 27 (63%) больных было зарегистрировано раннее прогрессирование заболевания (после 1-3 курсов химиотерапии). Следует отметить, что подавляющее большинство этих пациентов (15-88%) имели IV стадию заболевания и относились к группам неблагоприятного прогноза (3-4 фактора по МПИ).
Нами определена эффективность комбинированной химиолучевой терапии при I-II стадиях ДККЛ. В 10 (43,5%) случаях при I-II стадиях НХЛ больные получали лучевую терапию в составе комбинированного лечения после 3 курсов химиотерапии с последующим проведением еще 3 курсов (“sandwich”). После полной программы лечения (6-8 курсов химиотерапии) лучевую терапию получили 13 (56,5%) пациентов.
Рецидивы у больных с I и II стадиями ДККЛ после химиолучевого лечения были выявлены в 11 (48%) случаях, причем в 9 (82%) из них лучевая терапия проводилась в составе “sandwich”, и лишь в 2 (18%) случаях – после полной программы химиотерапии. Таким образом, в подавляющем большинстве случаев (в 9 из 11) рецидивы лимфомы отмечены у больных, которым лучевая терапия проводилась после первых 3 курсов химиотерапии в составе “sandwich”.
Из 136 больных, поступивших в отделение химиотерапии гемобластозов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России за период с января 1995 г. по январь 2003 г., к моменту окончания исследования (январь 2004 г.) 73 (53,7%) пациента умерли от прогрессирования ДККЛ и/или от осложнений химиотерапии; 51 (37,5%) больной находился в состоянии полной ремиссии в течение 1 и более лет, остальные 12 (8,8%) пациентов продолжали лечение. Медиана наблюдения составила 18,5 мес.
Анализ выживаемости показывает, что более половины больных (41 человек – 56,2% от всех умерших) умерли в течение первого года заболевания. В последующем смертность снижалась: в течение второго года умерли 20 (27,4%) больных, а в течение последующих 3 лет – 12 (16,4% от всех умерших пациентов) больных. Медиана общей выживаемости составила 16 мес.
В соответствии с литературными данными общепринятым сроком оценки прогноза агрессивных НХЛ является 2-летняя выживаемость. С этой целью проведено сравнение основных клинико-лабораторных параметров, характеризующих течение диффузной крупноклеточной В-клеточной лимфомы, в двух группах: в первую вошли пациенты, пережившие 2-летний период, во вторую – больные, умершие в течение 2 лет после начала лечения.
Исходя из данных однофакторного анализа, более 1/3 пациентов в каждой группе были старше 60 лет, причем большее количество пожилых пациентов были в группе умерших (43% против 36% больных в группе с благоприятным исходом). Однако статистические различия выживаемости по всем возрастным группам не достигли статистической значимости (р>0,05). При анализе взаимосвязи возраста с другими клинико-лабораторными характеристиками диффузной В-крупноклеточной лимфомы выявлено несколько закономерностей: высокий уровень ЛДГ сыворотки крови (>750 Ед./л) достоверно чаще встречался у молодых пациентов (р=0,042), с высокой степенью статистической значимости у пациентов моложе 60 лет чаще наблюдалось поражение средостения и легких (р<0,005).
Прослежена четкая зависимость выживаемости от стадии лимфомы, установленной в момент диагностики заболевания согласно Анн-Арборской классификации. Если при I стадии 2-летняя выживаемость составила 89%, то во II-III – 63%, а в IV – 30%. Различия статистически значимы (p<0,005) (рис. 3).
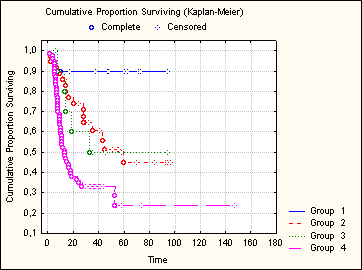
Рис. 3. Влияние стадии заболевания на общую выживаемость больных ДККЛ.
Мы предположили, что влияние на прогноз лимфомы оказывает не только стадия заболевания, но и характер распространения опухолевого процесса к моменту начала специфической терапии. Проанализировано влияние на выживаемость 22 выявленных локализаций опухолевого поражения у больных ДККЛ в исследуемой группе. Результаты позволяют заключить, что из нодальных поражений лишь изменение внутрибрюшных и забрюшинных лимфатических узлов оказывает статистически значимое влияние на прогноз диффузной В-крупноклеточной лимфомы (р=0,004). Из экстранодальных проявлений достоверные различия в 2-летней выживаемости выявлены лишь при поражении костного мозга (р=0,047).
Высокоинформативным при однофакторном анализе и обладающим высоким диагностическим коэффициентом при многофакторном оказался признак, не упоминающийся в доступной нам отечественной и зарубежной литературе, – общее количество специфически пораженных зон. Отмечено четкое снижение 2-летней выживаемости по мере увеличения количества зон поражения. Если при наличии у пациентов менее 4 локализаций 2-летняя выживаемость составила 61,5%, то при выявлении более 7 специфически измененных зон этот показатель равнялся всего 8%; различия статистически значимы (р=0,001) (рис. 4).
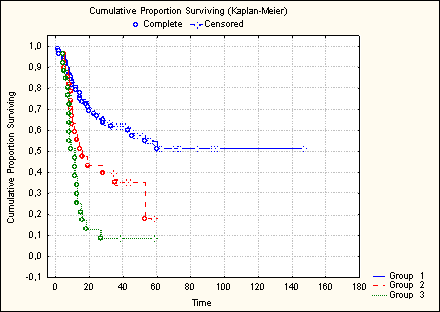
1 группа - 1-3 зоны поражения; 2 группа - 4-6 зон поражения;
3 группа - >7 зон поражения.
Рис. 4. Влияние количества зон специфического поражения на общую выживаемость больных ДККЛ.
Анализ прогностической ценности симптомов интоксикации также выявил ее высокую значимость (р=0,003). Присоединение В-симптомов в 3 раза чаще отмечалось в группе больных с летальным исходом. При оценке тяжести общего состояния больных по шкале ECOG до начала специфического лечения отмечена статистически значимая корреляция IV степени ECOG с неблагоприятным исходом лимфомы. Так, среди 17 пациентов в крайне тяжелом состоянии 23% умерли и всего 6% пережили 2-летний срок (р=0,012). Проведен анализ выживаемости больных ДККЛ в зависимости от наличия или отсутствия большой опухолевой массы (“bulky”). Эта клиническая ситуация была выявлена в 74% случаях в группе с летальным исходом и в 54% среди выживших пациентов (р=0,025).
Прогностическая роль уровня гемоглобина обсуждается во многих работах, посвященных изучению НХЛ; мнения по этому вопросу весьма разноречивы. В нашем исследовании низкое (<100 г/л) содержание гемоглобина значительно (р=0,034) чаще наблюдалось в группе больных, умерших в течение 2 лет после начала лечения, в то время как нормальный уровень гемоглобина в такой же мере превалировал в группе выживших пациентов, что позволило отнести этот параметр к прогностически значимым. Подтверждена статистически достоверная (р=0,003) корреляция высокого уровня ЛДГ с наиболее низкой 2-летней выживаемостью: уровень фермента > 50 Ед./л зарегистрирован в 48% случаев в группе больных с летальным исходом против 20% выживших пациентов.
Помимо ЛДГ, уточнить прогноз течения диффузной В-крупноклеточной лимфомы можно с помощью определения содержания в сыворотке крови больного общего белка и альбуминов. Нами выявлено статистически значимое отрицательное влияние на 2-летнюю выживаемость снижения уровня общего белка <65 г/л и, в большей степени, – альбуминов <35 г/л (р=0,004).
В исследовании было проанализировано влияние на выживаемость каждого в отдельности из 5 неблагоприятных факторов, вошедших в МПИ. Однако мы посчитали необходимым определить прогностическую значимость совокупности того или иного количества этих показателей согласно 4 группам риска раннего прогрессирования по МПИ. Так, среди выживших пациентов 40% были отнесены к группе низкого риска в сравнении с 10% в группе с летальным исходом (р=0,012). Отмечено высоко значимое (р=0,001) влияние на 2-летнюю выживаемость совокупности 4-5 факторов: среди выживших пациентов лишь 6% были отнесены к высокой степени риска против 42% в группе больных с летальным исходом (рис. 5).
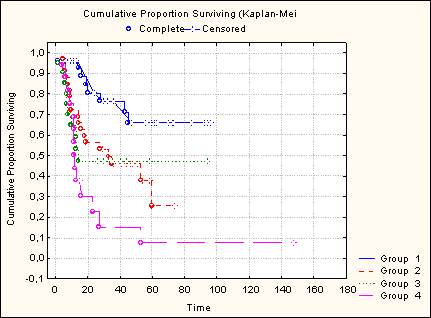
Рис. 5. Влияние группы риска раннего прогрессирования по МПИ на общую выживаемость больных ДККЛ.
В особую группу прогностических факторов необходимо выделить непосредственные результаты I линии химиотерапии (достижение полной ремиссии, частичной ремиссии или прогрессирование), определяющие чувствительность опухоли к специфическому лечению. Так, в группе больных с благоприятным исходом полная ремиссия была достигнута в подавляющем большинстве случаев (94%), тогда как среди умерших пациентов полный эффект получен лишь у 28% больных (p<0,0001). Если в результате I линии химиотерапии получена частичная ремиссия, то имеет место обратная тенденция: 26% в группе с летальным исходом против 6% среди выживших пациентов (p=0,005). В случае прогрессирования заболевания во время лечения ни один больной не пережил 2-летний период (p<0,0001).
Таким образом, задачей индукционного лечения при ДККЛ является достижение полной ремиссии, а частичный эффект необходимо отнести к неудачам лечения.
С помощью многофакторного дисперсионного анализа выявлены факторы, статистически значимо влияющие на выживаемость (общую и бессобытийную):
Непосредственные результаты I линии химиотерапии:
12) полная ремиссия, p<0,0001, мощность=1;
13) прогрессирование, p<0,0001, мощность=0,9;
14) частичная ремиссия, p=0,005, мощность=0,8
Таким образом, тщательно собранный анамнез и клиническое обследование больного позволяют выделить критерии неблагоприятного прогноза. К ним относятся такие клинические факторы как возраст (старше 60 лет), симптомы интоксикации, локализация опухолевых очагов и их количество (более 7), наличие экстранодальных поражений, распространенная стадия заболевания, наличие большой опухолевой массы ("bulky"), тяжесть общего состояния и непосредственные результаты I линии терапии, а также изменения лабораторных параметров (повышение уровня ЛДГ, анемия, гипопротеинемия и гипоальбуминемия).