ДИАГНОСТИКА И ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ПЕЧЕНИ
Патютко Ю.И., Сагайдак И.В., Котельников А.Г., Подлужный Д.В., Бадалян Х.В.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Авторы работают в хирургическом отделении опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
По всем интересующим вопросам можно обращаться:
Сагайдак Игорь Всеволодович тел. 324-91-04,
Подлужный Данил Викторович тел. 324-90-55
В России заболеваемость первичным раком печени не превышает 3-5% среди всех злокачественных опухолей. Ежегодно в России регистрируется 40000 заболеваний раком толстой кишки. От 20 до 50% больных колоректальным раком при первичном обращении имеют метастазы в печень. Из числа больных, подвергшихся потенциально радикальному лечению и не имеющих в последствии рецидивов, почти у 55% выявляются метастазы в печень.
К сожалению, до настоящего времени подавляющее большинство врачей общей лечебной сети и значительная часть онкологов относится к пациентам с вторичным опухолевым поражением печени как к инкурабельным больным, проводят им симптоматическую терапию или назначают малоэффективные лекарственные препараты.
Диагностика опухолей печени
Скрининг первичного рака печени нуждается в совершенствовании и основан на определении в крови обследуемых лиц в группах риска один раз в 6 месяцев Альфа-фетопротеина (АФП) и, в случае повышении его концентрации свыше 15 нг/мл (мкг/л) (для большинства взрослых лиц, исключая беременных женщин), выполнении ультразвукового исследования (УЗИ) печени. При этом обнаружение образования в печени практически свидетельствует о наличии у пациента печеночно-клеточного рака. Группа риска первичного рака печени в регионах с низким и средним уровнем заболеваемости данной патологией состоит из больных хроническими заболеваниями печени. В регионах эндемичных по вирусному гепатиту В группа риска включает лиц мужского пола старших возрастных групп - носителей поверхностного антигена вируса гепатита В (HBs-Ag).
Выявление метастатических опухолей печени основано на иммунохимическом и инструментальном мониторинге за больными, ранее получавшими лечение по поводу опухолей любых локализаций. Среди ассоциированных с опухолью антигенов, определяемых в крови у наблюдаемых лиц, наибольшее практическое значение имеют: АФП, Раково-эмбриональный антиген (РЭА), СА 19-9, СА 125, Хорионический гонадотропин (ХГ), Простатический специфический антиген (ПСА). Роль этих маркеров опухоли при метастатическом раке значима, когда их уровень до лечения по поводу первичных опухолей был повышен. Нормальные концентрации указанных маркеров в крови среди взрослых: АФП - до 15мкг/л (исключая беременных), РЭА - до 5 мкг/л, СА 19-9 - до 37 Ед/мл, СА 125 - до 35 Ед/мл, ХГ - до 20 мЕд/мл (исключая беременных), ПСА - до 3 мкг/л.
Положительная реакция на альфа-фетопротеин отмечается у 70-90% больных гепатоцеллюлярным раком печени.
Наиболее известным маркером колоректального рака является раково-эмбриональный антиген (РЭА) открытый в 1965г Gold and Freedman. РЭА - гликопротеин, располагающийся в периферических слоях клеточной мембраны. Его ген относится к семейству генов, ответственных за синтез иммуноглобулинов. РЭА - не обязательный маркер. У 40% больных раком толстой кишки он не выявляется. Он обнаруживается и при других злокачественных опухолях (рак молочной железы, поджелудочной железы, легкого, яичников и даже саркомах), а также в эмбриональной ткани и при не злокачественных заболеваниях (гепатотоксичность, гидронефроз, желчнокаменная болезнь). При метастазах рака РЭА чаще позитивный, при локальном раке - негативный (27). После радикальных операций систематическое определение РЭА позволяет выявить в 47% случае рецидивы (в том числе и бессимптомные).
Маркер СА-19-9 является гликопротеидом, по структуре напоминающий муцин. Значение до 37 Е/л считается нормальным. Он также имеет прогностическое значение при раке толстой кишки.
Для выработки правильной лечебной тактики среди предполагаемых больных первичным или метастатическим раком печени целесообразно решить ряд диагностических задач. Эти задачи следующие:
В основе диагностического алгоритма лежат инструментальные, преимущественно лучевые, методы диагностики. После клинического осмотра больного, лабораторных анализов, рентгенографии легких выполняется диагностический комплекс: Ультразвуковое исследование (УЗИ) печени или Рентгеновская компьютерная томография (РКТ) + иммунохимические тесты на маркеры опухоли в крови + тонкоигольная пункционная цитобиопсия опухоли в печени. Вместо РКТ может быть выполнена магнитно-резонансная томография (МРТ). В ряде случае УЗИ и РКТ не позволяют с уверенностью дифференцировать различные хорошо васкуляризированные опухоли: печеночно-клеточный рак, гепатобластому, метастазы в печени рака почки, ангиосаркому печени, гемангиому печени. Тогда возможно выполнение эмиссионной компьютерной томографии с меченными эритроцитами. Метод достоверно позволит сказать: является ли образование печени по своей природе сосудистым или не сосудистым.
Диагностический комплекс "УЗИ + маркеры в крови + пункция опухоли печени" позволяет достоверно судить о морфологической структуре опухоли печени, ее размерах, долевой и сегментарной локализации, наличии асцита, распространенности опухоли на ворота печени, отсевах внутри печени, наличии опухолевых тромбов в ветвях воротной вены и печеночных вен, поражении лимфоузлов брюшной полости, распространении опухоли на прилежащие к печени органы или отдаленные метастазы. Словом, этот диагностический комплекс уже решает все 10 поставленных диагностических задач. Если при этом диагностируется метастатический рак печени и в анамнезе больного нет данных о выявлении и лечении по поводу первичной опухоли, а метастазы в печени носят множественный характер с билобарным поражением органа, то проведение Ангиографии печени не целесообразно. При этом, как правило, решается комплекс вопросов, связанных с выявлением первичной опухоли - источника метастазов в печени. Описанная выше последовательность диагностического поиска осуществляется в амбулаторных условиях.
Ангиография печени выполняется в специализированной клинике при выявлении у больного на предшествующем этапе первичного рака печени или метастатического рака, если имеется унилобарное поражение печени метастазами, когда не исключено хирургическое лечение больного.
Краткая клиническая характеристика применяемых инструментальных методов исследования.
Достоинствами ультразвукового исследования являются: метод позволяет дифференцировать солидные образования и жидкость содержащие кисты, гемангиомы и злокачественные опухоли. Метод высокоинформативен в определении пораженной доли и сегментов печени, позволяет судить о состоянии ворот, инвазии опухоли в прилежащие к печени органы, выявляет увеличенные лимфоузлы ворот печени, гепатодуоденальной связки, панкреатодуоденальных и парааортальной групп, асцит. Метод информативен в выявлении изменений внутрипеченочных трубчатых структур. Информативность метода в отношении сосудов печени и ворот органа еще более возрастает, если применяется ультразвуковое допплеровское исследование. Метод является щадящим для больного, дешевым. Комбинирование метода с тонкоигольной пункционной цитобиопсией позволяет достоверно судить о морфологическом строении опухоли в печени. Интраоперационное УЗИ необходимо при операциях на печени по поводу опухолей, поскольку позволяет выявить внутрипеченочные не пальпируемые метастазы и опухолевые тромбы, идентифицировать опухолевые узлы при циррозе печени, уточнить внутрипеченочную сосудистую архитектуру. Последнее обеспечивает выполнение в случае необходимости сегментарной резекции печени.
Рентгеновская компьютерная томография (РКТ), обладая многими достоинствами ультразвукового исследования, является наиболее информативным методом в диагностике первичного рака печени. С помощью метода внутривенного "усиления" РКТ позволяет дифференцировать первичный рак печени от гемангиом, узлов регенераторной гиперплазии, метастазов опухолей внепеченочных локализаций. С помощью РКТ выявляются жидкие, жировые, газовые включения, кальцинаты. Метод также информативен в топической диагностике опухолей печени.
Магнитно-резонансная томография (МРТ) не менее чем РКТ информативна в обнаружении внутрипеченочных отсевов опухоли, распространении опухоли на ворота печени, дифференциальной диагностике рака и хорошо васкуляризированных образований печени (узловая гиперплазия, аденома, гемангиома).
Тонкоигольная пункционная цитобиопсия (ТПЦ) - метод морфологической диагностики опухолей печени осуществляется под контролем УЗИ, РКТ, лапароскопии, при пальпируемых опухолях "в слепую". Может выполняться неоднократно, в амбулаторных условиях. Осложнениями практически не сопровождается. Используются иглы длиной 10-15 см с наружным диаметром иглы 0,5 - 1,2 мм. Конец иглы может иметь сложную конфигурацию, способствующую взятию материала. Значение пункции, как метода морфологической диагностики, возрастает в случае установления нерезектабельности процесса в печени.
Ангиография (АГ). Рентгенологическое исследование сосудов печени высокоинформативно в установлении природы, характера опухоли печени, распространенности процесса внутри и вне печени. Метод позволяет довольно точно предположить гистогенез опухоли печени. Четкая визуализация печеночных артерий во время целиакографии, воротной вены и ее ветвей при возвратной сплено-(мезентерико-) портографии, нижней полой вены при нижней каваграфии - дает пока незаменимую информацию о сосудистой анастомии печени, ее воротах. То есть метод позволяет достоверно судить о резектабельности процесса в печени.
При выполнении представленного диагностического инструментального комплекса обследования больного первичным и метастатическим раком печени в большинстве случаев удается ответить на вопрос - удалима ли опухоль печени. Если опухоль печени представляется удалимой, то важнейшим является решение диагностических задач 2-й группы.
Эти задачи следующие:
Методы оценки функционального состояния печени:
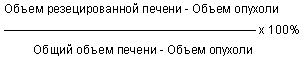 |
Наряду с оценкой функционального состояния паренхимы печени, проводится изучение функционального состояния миокарда (по данным ЭКГ, Эхокардиографии), функции внешнего дыхания (спирометрия), функции почек (радиоизотопное исследование секреторно-экскреторной функции почек), свертывающей системы крови (коагулограмма).
В результате решения диагностических задач двух групп с высокой степенью вероятности можно судить, во-первых, о резектабельности процесса в печени, во-вторых, о прогнозе лечения и заболевания.
Хирургическое лечение опухолей печени.
Резекция печени при наличии злокачественного образования в ней требует соблюдения двух взаимосвязанных условий:
Эти два положения являются краеугольным камнем в печеночной хирургии и должны доминировать в сознании хирурга над всеми другими моментами в течение всей операции. В идеале линия резекции должна отступать от края опухоли не менее чем на 1 см, однако при больших опухолях это условие соблюдать трудно, особенно при удалении больших опухолей, связанных с НПВ или печеночными венами в межсекторальных сосудистых границах, а также при локализации их вблизи ворот печени. Поскольку есть сообщения о длительном выживании больных при небольшом отступлении разреза от опухоли (менее1см), данное обстоятельство не должно сдерживать хирурга. По мнению ряда авторов любой микроскопически чистый край резекции следует считать адекватным.
Для контроля за кровотечением, прежде всего, необходимо точное знание хирургической анатомии печени. Но поскольку строение ворот печени, расположение трубчатых структур ее, характер впадения печеночных вен имеют значительные индивидуальные вариации, для их определения в каждом конкретном случае следует прибегать не только к тщательному предоперационному обследованию (ангиография, портография и т.п.), но и применению интраоперационной ультразвуковой томографии. Последний метод особенно важен, т.к. позволяет не только уточнить распространенность опухолевого процесса, но и индивидуализировать особенности сосудистой архитектоники печени, установить отношение опухоли к крупным венозным сосудам.
Другим моментом для контроля за кровотечением является выполнение ряда технических приемов. Самым важным и наиболее часто применяемым является так называемый Pringle-маневр - пережатие структур гепатодуоденальной связки с помощью петли. Безусловно, безопасная длительность пережатия сосудов составляет 15-20 минут, хотя в литературе описана и более длительная окклюзия - до 70 минут, правда, при отсутствии цирроза печени. Мы более чем на 20 минут связку не пережимали, т.к. этого промежутка времени нам всегда было достаточно для завершения основных манипуляций на печени.
В 1974г J. Fortner et al. для профилактики кровотечений при обширных резекциях предложили способ полной сосудистой изоляции печени, заключающийся в окклюзии сосудов ворот печени, пережатии НПВ над и под печенью и гипотермической перфузии печени. Время общей печеночной ишемии при этом способе может достигать 90 минут. Хотя этот метод имеет немало сторонников, он довольно сложен и требует большого количества жидкости для перфузии. Даже сам автор, доктор J. Fortner, признает, что метод не может использоваться рутинно. Мы ни разу не прибегали к данному способу, как и большинство печеночных хирургов.
Более проста и, следовательно, чаще применима модифицированная техника общей печеночной окклюзии без перфузии гипотермических растворов. На наш взгляд она показана при повреждении НПВ или печеночных вен, во избежании циркуляторных расстройств вследствии отсутствия поступления крови в сердце из НПВ, длительность ее проведения не должна превышать 10 мин. Данный способ был нами применен дважды - при правосторонней гемигепатэктомии и при резекции VIII сегмента.
Бескровному оперированию помогает использование специальной хирургической техники - ультразвукового дезинтегратора, в том числе и отечественного (Нижний Новгород), гармонического скальпеля, водоструйного, плазменного скальпеля, аргонового коагулятора, специальных клеящих материалов (Тахокомб и т.п.), двухкомпонентного фибринового клея. Однако широкое их внедрение ограничено из-за высокой стоимости.
Операционный доступ.
В последние годы при всех операциях на правой доли печени и при обширных резекциях левой доли мы используем 2-х подреберный разрез с последующей его коррекцией подреберными ретракторами, которые крепятся к операционному столу (РСК-10). Этот доступ позволяет свободно манипулировать на всех отделах печени и лишь в отдельных случаях требуется дополнительный разрез от вершины его до мечевидного отростка ("мерседесообразный" разрез). Мы, как и большинство печеночных хирургов, полностью отказались от торакоабдоминального доступа из-за его травматичности и большого числа осложнений. Срединная лапаротомия адекватна для резекции левой анатомической доли или при необходимости одновременной операции в малом тазу (резекция прямой и сигмовидной кишки, удаление яичников и т.п.). Других доступов при операции на печени мы не применяли. Техника операции на печени.
Как и большинство авторов, мы выделяем обширные резекции печени (право- и левосторонняя гемигепатэктомия простая и расширенная), сегментарные резекции печени (чаще всего IV сегмент, II и III сегменты, VIII сегмент, VI-VII сегменты, редко I сегмент) и атипичные резекции печени (любое сочетание сегментов, краевые резекции). Последний вид операции в нашей клинике производится крайне редко.
В задачи данной работы не входит детальное описание каждого вида операции, поэтому мы ограничились некоторыми принципиальными моментами.
Для детальной ревизии печени при любой локализации первичной или метастатической опухоли необходима полная ее мобилизация, т.к. задняя часть печени первоначально недоступна для пальпации и маленькие очаги этой зоны могут быть пропущены даже при интраоперационном ультразвуковом исследовании.
Серповидная связка в самом начале операции рассекается по всей длине. Проводится первичная бимануальная пальпация печени. Затем рассекается малый сальник, палец вводится в сальниковую сумку для пальпации I сегмента (хвостатой доли). Затем проводится ультразвуковое исследование печени для выявления всех возможных поражений и соотношения опухоли с крупными сосудами. Затем исследуются лимфатические узлы ворот печени. При любом подозрении проводится их срочное гистологическое исследование. Наличие метастазов в лимфоузлы ворот печени при первичном раке требует широкой лимфодиссекции. При метастазах в этой области у больных метастатическим раком печени делает резекцию ее малообоснованной.
Если на основании полученных данных принимается решение о резекции печени, проводится ее полная мобилизация путем рассечения связок печени. После этого необходимо еще раз бимануально обследовать печень. Если опухоль врастает в диафрагму, сегмент ее иссекается с последующим ушиванием. Если дефект в диафрагме большой, весьма полезным бывает ревизия легкого. В одном случае мы обнаружили при этом маленький метастаз в нижней доле, не определяемый при дооперационной рентгенографии, и произвели клиновидную резекцию легкого.
Сегментарные резекции II-III сегментов, VI-VII сегментов, даже IV сегмента больших сложностей не представляют. Резекция же VIII сегмента, а также изолированное удаление I сегмента являются крайне сложными оперативными вмешательствами.
При резекции VIII сегмента мы согласны с некоторыми авторами (Y. YU et al., 1993), что при пережатых воротах печени (Pringle-маневр) оптимальным является разрез печени вокруг опухоли, отступя на 1-2 см от ее края. Паренхима разделяется постепенно с помощью инструментов (изогнутых), начиная с правой стороны опухоли. При приближении к правой печеночной вене перевязываются ее ветви, но сам ствол сохраняется. Затем выделяется левая сторона опухоли, начиная снизу вверх, ветви средней печеночной вены также перевязываются. Обработка НПВ зависит от ее отношения к опухоли. Если нет инфильтрации стенки вены, опухоль легко отделяется от НПВ. При повреждении НПВ или при врастании в нее опухоли на небольшом протяжении, необходима полная сосудистая изоляция печени, о чем говорилось выше.
Большинство авторов допускают перевязку одной из главных печеночных вен (правую или среднюю) при инфильтрации ее опухолью. Перевязка обеих вен нежелательна, так как отток в этом случае от правой доли будет происходить только через 4-5 коротких вен печени и через мелкие коллатерали к левой доли, что приводит к блоку циркуляции и развитию печеночной недостаточности.
Изолированное удаление I сегмента лучше всего производить с использованием методики, предложенной J. Lerut, et al. 1990. По этой методике правая и левая доли отделяются от диафрагмы, затем правая доля сдавливается медиально. После этого все короткие вены, начиная снизу вверх, выделяются и пересекаются, тем самым вся задняя поверхность мобилизуется от ретропеченочной части НПВ настолько вверх, насколько это возможно, в идеале до основных печеночных вен. Выделение распространяется и на левую половину передней поверхности НПВ, где лигируются вены, дренирующие I сегмент под визуальным контролем. Далее в воротах выделяются левые портальные вены и печеночная артерия для того, чтобы перевязать ветви, снабжающие хвостатую долю. Теперь окклюзия кровотока завершена, что позволяет произвести резекцию I сегмента. На наш взгляд эту методику целесообразно сочетать с передне-латеральным подходом к хвостатой доли, когда она мобилизуется через желудочно-печеночную связку.
Обширные резекции печени мы предпочитаем выполнять воротным способом. Наш довольно большой опыт (96 обширных резекций) позволяет утверждать, что при надлежащей тщательности выделения и достаточном терпении практически во всех случаях возможна перевязка трубчатых структур в воротах печени. Мы считаем принципиальным выделение и перевязку левой или правой (в зависимости от характера операции) воротной вены, что сразу же выявляет демаркационную линию. Перевязка и пересечение соответствующих стволов печеночного протока и артерии может быть произведена и интрапаренхиматозно, хотя в идеале это лучше сделать изолированно в воротах печени.
Интересным, на наш взгляд, является предложение Y Jamieson (1992), заключающееся во внутрипеченочном определении и перевязке портальной триады в зоне печени, которая будет удаляться. Авторы показали наличие глиссоновой капсулы вокруг этой триады внутри печени, что уменьшает риск повреждения трубчатых структур при их выделении. При этом способе не производится попытка раздельного выделения воротных структур, а делается глубокий разрез ткани печени почти вертикально в медиальной части ложа желчного пузыря при пережатой гепатодуоденальной связке. Используя либо пальцевое раздавливание паренхимы, либо изогнутый зажим выделяется вся правая печеночная триада в капсуле и затем перевязывается и пересекается.
Перевязка и пересечение печеночных вен может быть произведена как вне печени, так и интрапаренхиматозно. Следует помнить, что правая печеночная вена почти всегда впадает в НПВ самостоятельно. Левая и средняя вены перед впадением чаще сливаются в один ствол. Эти особенности устанавливаются путем интраоперационной ультразвуковой томографии.
Фиссуральный способ обширной резекции печени в последние годы мы практически не применяем, поэтому на нем здесь мы останавливаться не будем.
Не будем мы также касаться техники расширенной гемигепатэктомии, так как эти крайне сложные оперативные вмешательства требуют отдельного рассмотрения. Они являются уделом крупных специализированных клиник и не могут быть рекомендованы к выполнению в общих хирургических стационарах.
С 1990г в отделении выполнено 261 операция на печени при ее опухолевом поражении. Обширных резекций печени произведены у 96 больных, экономных резекций у 165 . По поводу первичного рака печени произведено 79 вмешательств, метастатического рака - 140 вмешательств, остальные 42 операции произведены по поводу доброкачественных опухолей. Объем выполненных вмешательств представлен в таблице 1.
Таблица 1.
Характер оперативных вмешательств при опухолях печени.
| Объем операции | Число больных | Леталь- ность |
||
|---|---|---|---|---|
| Абс. число | % | Абс. число | % | |
| Расширенная правосторонняя гемигепатэктомия | 8 | 3,0 | 1 | 12,5 |
| Расширенная левосторонняя гемигепатэктомия | 3 | 1,1 | -- | -- |
| Правосторонняя гемигепатэктомия | 63 | 24,4 | 10 | 15,9 |
| Левосторонняя гемигепатэктомия | 22 | 8,4 | 1 | 4,5 |
| Левосторонняя кавальная лобэктомия | 34 | 13,0 | 2 | 5,9 |
| Правосторонняя латеральная лобэктомия | 29 | 11,1 | -- | -- |
| Резекция IV и V сегментов | 23 | 8,8 | -- | -- |
| Атипичные резекция в пределах 2 сегментов | 27 | 10,3 | 1 | 3,7 |
| Резекция одного сегмента | 31 | 11,9 | -- | -- |
| Атипичные резекции | 21 | 8,0 | 1 | 4,7 |
| Всего | 261 | 100 | 16 | 6,1 |
Значительные трудности при выборе объема операции возникают при небольших опухолях, расположенных на границе долей. Выполнение обширных резекций печени у данной группы больных приводит к удалению значительного объеме неизмененной паренхимы печени, что крайне опасно из-за высокой вероятности развития печеночной недостаточности.
Летальность среди всех больных перенесших резекцию печени составила 6,1%. Безусловно, большую часть (12,5%) из них составили больные после обширных резекций печени. Все больные после экономных резекций (2,4%) печени погибли от общехирургических осложнений.
Причины послеоперационной летальности представлены в таблице 2.
Таблица 2.
Причина послеоперационной летальности у больных, перенесших
резекцию печени.
| Осложнение | Число больных | |
|---|---|---|
| Абс. число | % | |
| Интаоперационное кровотечение, ДВС синдром | 6 | 37,5 |
| Кровотечение из острой язвы 12-перстной кишки | 2 | 12,5 |
| Гнойно-септические осложнения | 3 | 18,7 |
| Печеночная недостаточность | 3 | 18,7 |
| Острая сердечная недостаточность | 1 | 6,3 |
| Тромбоэмболия легочной артерии | 1 | 6,3 |
| Всего | 16 | 100 |
Наиболее грозным осложнением остается кровотечение. Оно явилось наиболее частой причиной смерти больных после резекции печени. Выраженная печеночная недостаточность отмечена у 8 больных, и только у 3 из них это явилось причиной смерти в послеоперационном периоде.
Необходимо отметить, что накопленный нами опыт позволил в последние годы значительно расширить показания к обширным резекциям печени. В настоящее время возраст больных, наличие цирроза печени, выраженной сопутствующей патологией не являются абсолютным противопоказанием к операции.
Повторные резекции печени.
Повторной резекции печении было подвергнуто 14 больных. Из них у 5 - первичная операция была проведена по поводу первичного рака печени, у 9 - метастатического поражения печени.
Из 14 больных 12 были подвергнуты первой резекции печени в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, 2 больных в других учреждениях. После первой резекции печени больные проходили динамическое наблюдение в поликлинике нашего центра. Обследование каждые 3 месяца у всех больных включало ультразвуковое исследовании печени и биохимическое исследование крови. У больных, оперированных по поводу первичного рака печени, исследовался уровень альфа-фетопротеина в крови. При подозрении на наличие рецидивной опухоли обследование дополнялось КТ, агиографией и пункционной аспирационной биопсией опухолевого узла. Из всех 14 больных рецидив выявлен у 6 (42,8%) на 1 году, у 4 (28,6%) на 2 году после первой резекции печени. У остальных 4 (28,6%) больных рецидив в печени выявлении через 2 и более года (Таблица 3).
Таблица 3.
Сроки выполнения повторных резекций печени (после первой операции на печени).
| До 1 года | 1-2 года | Больше 2 лет | |
|---|---|---|---|
| Первичный рак печени | 2 | -- | 3 |
| Метастатический рак печени | 4 | 4 | 1 |
| Всего | 6 | 4 | 4 |
Из 5 больных, оперированных по поводу рецидива первичного рака печени, только у одной больной рак был на фоне крупноузлового цирроза печени. У всех 5 больных опухоль имела строение гепатоцеллюлярного рака. Рецидивная опухоль локализовалась у 3 больных в правой доле печени, и у 2 больных - в левой доле печени . Размер опухолевого узла не превышал 5 см у 3 больных. При первой операции опухоль была в виде солитарного узла у 65,7% больных первичным раком печени, тогда как повторные операции выполнялись только при солитарном узле в печени .
Повторным резекциям печени по поводу метастазов подверглось 9 больных. Из них 6 больных оперированы по поводу метастазов колоректального рака, 3 больных - по поводу метастазов рака желчного пузыря, надпочечника и почки. У большинства (7 больных) метастазы были в правой доле печени и не превышали 5 см. Повторные операции, так же как и при первичной резекции печени, выполнялись чаще при солитарном поражении печени.
При выборе объема оперативного вмешательства мы придерживались тех же принципов, что и при первичной резекции печени. Однако повторные операции имеют ряд особенностей. В настоящее время повторные резекции печени мы производим при следующих показаниях:
Важным вопросом при повторных операциях на печени является объем оперативного вмешательства. При повторных операциях нами реже выполнялись обширные операции. Однако это не означает, что мы сужали показания для обширных резекций, а связано с тем, что у 4х больных одна из анатомических долей была удалена при первой операции.
Среди 14 больных, подвергшихся повторной резекции, послеоперационной летальности не было. Однако необходимо отметить, что повторные операции являются технически более сложными по следующим причинам:
Во всех случаях нами применялся двухсторонний подреберный разрез с иссечением старого рубца. Наиболее массивные сращения отмечаются между латеральной, диафрагмальной поверхностью печени и париетальной брюшиной. Выделение печени мы всегда производим острым путем под визуальным контролем, стараясь, с одной стороны, не повредить капсулу печени, что вызывает паренхиматозное кровотечение, с другое стороны, не вскрыть правый плевральный синус. Не допустима мобилизация печени тупым путем, что неминуемо ведет к декапсуляции печени и выраженному паренхиматозному кровотечению. Мобилизацию печени следует проводить от периферии к центру, планомерно выделяя ее от сращений с толстой, двенадцатиперстной кишкой, дистальной частью желудка. Особая осторожность требуется при выделении задней поверхности, так как спаечный процесс распространяется на надпочечник, нижнюю полую вену. Мобилизация левой доли печени, как правило, особых проблем не вызывает. Здесь, обычно, требуется только рассечение спаек между печенью и желудком.
Особого внимания требует выделение трубчатых структур в воротах печени. При необходимости выполнения гемигепатэктомии, что на нашем материале имело место в 5 наблюдениях, нам ни разу не удалось полностью выделить долевую триаду в воротах печени и во всех случаях операция производилась фиссуральным способом.
Эти трудности отражаются прежде всего на интраоперационной кровопотери. Правда, если интраоперационная кровопотеря при первой и повторной экономной резекции печени существенно не отличалась, то при обширных резекциях печени объем кровопотери выше при повторных операциях.
На основании вышеизложенных данных, мы полагаем, что повторные резекции печени выполняются достаточно редко, однако их выполнение оправдано, если поражение печени является единственным проявлением прогрессирования болезни.
Отдаленные результаты хирургического лечения первичного рака печени и факторы прогноза.
В ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России выполнено 79 резекций печени по поводу первичного рака. Нами изучены отдаленные результаты 47 больных, которые могли прожить 3 и более лет, и 36 больных, которые могли прожить 5 и более лет. Один год прожили все больные, подвергшиеся резекции печени и выписанные из стационара. Пятилетняя выживаемость больных после экономной резекции печени составила 35,7%. Среди больных, подвергшихся гемигепатэктомии, пятилетняя выживаемость составила 41,2%.
По данным литературы пятилетняя выживаемость после хирургического лечения первичного рака печени колеблется от 10,3% до 77,9% (Таблица 4).
Таблица 4.
Выживаемость радикально оперированных больных ПРП.
| Авторы | 3 года (%) | 5 лет (%) |
|---|---|---|
| Вишневский В.А. с соавт., 1996 | 31,0 | 10,3 |
| Гальперин Э.И. с соавт., 1994 | 25,7 | 17,8 |
| Патютко Ю.И. с соавт.,1999 | 48,9 | 33,3 |
| Yu Y., 1991 (Китай) | 43,2 | 39,2 |
| Wands J., 1991 (Великобритания) | --- | 70,0 |
| Cong W., 1993 (Китай) | --- | 77,9 (d<3 см) |
| Li Y. et al., 1994 (Китай) | 48,3 | 38,8 |
| Chou F. et al., 1994 (Тайвань) | 56,0 | 49,0 |
| Vauthey J. et al., 1995 (Нью-Йорк) | --- | 41,0 |
| Ebora M. et al., 1986 (Япония) | 52,5 | 36,6 |
Нами проведен анализ отдаленных результатов хирургического лечения первичного рака печени с учетом наиболее значимых факторов прогноза.
При анализе 5-летней выживаемости радикально оперированных больных нами не выявлено достоверных различий в зависимости от локализации опухоли в правой ( 36,1±7,3 %) и левой (32,1±8,5%) долях печени.
Получена достоверная разница в 5-летней выживаемости в зависимости от размера опухоли. У больных с размером опухолевого узла менее 5 см 5-летняя выживаемость составила 69,2±15,2%, тогда как больных с размером опухолевого узла более 5 см - 28,2±5,8%.
Важным прогностическим фактором является объем резекции печени. Ни один больной, перенесший расширенную гемигепатэктомию, не пережил 5 лет, тогда как после гемигепатэктомии и резекции печени меньшего объема 5-летняя выживаемость составила 25,1±7,3% и 44,6±8,7% соответственно. Различия статистически достоверны (Р<0,05).
Наличие внепеченочных поражений значительно ухудшает прогноз. Так, у больных, перенесших комбинированные резекции печени, 5-летняя выживаемость составила 17,6±6,1%.
К важным прогностическим факторам относятся также следующие признаки: форма роста опухоли, характер границ опухоли , наличие капсулы и некроза в опухоли. Современные диагностические средства (УЗТ, КТ, МР, ангиография) позволяют представлять данную информацию на дооперационном этапе, что делает эти факторы более значимыми.
Нами установлено, что 5-летняя выживаемость у больных с нечеткими контурами достоверно (Р<0,05) ниже по сравнению с пациентами, у которых контур опухоли четкий, и составила 14,7±8,9% и 38,9%±6,7% соответственно. Аналогичная картина выявлена и при анализе наличия капсулы опухоли. Так, 5-летняя выживаемость у больных с выраженной капсулой составила 44,9±11,9%, у больных с умеренно выраженной капсулой - 32,0±13,6% и при отсутствии капсулы - 22,3±12,2%.
Спонтанный некроз опухоли обычно встречается при опухолях больших размеров и с длительным анамнезом и является неблагоприятным прогностическим фактором.
Зависимость выживаемости от формы роста при ПРП показывает, что наиболее благоприятным является узловая форма, тогда как наличие диффузного роста относится к крайне неблагоприятным факторам прогноза.
Одним из важнейших факторов, определяющих радикальность выполняемой операции, является расстояние опухоли от линии резекции. Так 5-летняя выживаемость , по нашим данным, у больных с расстояние до линии резекции от 2 и более см. составила 56,9±9,9%, тогда как у остальных больных 20,6±6,0%. Различие статистически достоверно (Р<0,05).
К неблагоприятным факторам относятся также наличие морфологических признаков гепатита в паренхиме печени, цирроз печени, низкая степень дифференцировки опухоли, инвазия сосудов в опухоли и вне опухоли.
Для сравнения наших данных с литературными, приводим результаты 5-летней выживаемость с учетом факторов прогноза, полученную группой по изучению первичного рака печени в Японии 1994г (Таблица 5).
Таблица 5.
Пятилетняя выживаемость больных ПРП с учетом факторов прогноза (Япония).
| Фактор | ||
|---|---|---|
| Размер опухолевого узла | до 2 см - 51% | >10 см - 28% |
| Инфильтрация капсулы | (-) 40% | (+) 30% |
| Число пораженных сегментов | 1 сегм. - 40% | 3 сегм. - 18% |
| Наличие цирроза | (-) 40% | (+) 30% |
| Удаленность линии резекции от края опухоли | 1см и > 38% | Менее 1 см - 36% |
| HBsAg | (-) 40% | (+) 35% |
| Уровень a - фетопротеина | (-) 48% | (+) 20% |
| Вовлечение воротной вены | (-) 40% | (+) 28% |
| Радикальность вмешательства | Радикал. - 40% | Не радик. - 28% |
| Употребление алкоголя | (-) 40% | (+) 36% |
( Группа по изучению ПРП в Японии, 1994г., 5800 больных из 601 клиники).
Индивидуальное прогнозирование позволяет выделить группу лиц, нуждающихся в тщательном диспансерном наблюдении.
Метастазы в печень рака толстой кишки.
По поводу метастазов колоректального рака нами выполнено 94 резекции печени. Из них обширные резекции печени выполнены 43 больным (расширенная правосторонняя гемигепатэктомия - 4 больным, правосторонняя гемигепатэктомия - 32 больным, левосторонняя гемигепатэктомия - 7 больным). У 51 пациента операция заключалась в экономной резекции печени. Более детальная характеристика оперативных вмешательств представлена в таблице 6 и 7.
Таблица 6.
Объем оперативных вмешательств у больных метастазами рака толстой кишки (обширные резекции).
| Объем операции | Число |
|---|---|
| Расширенная гемигепатэктомия | 4 |
| Правосторонняя гемигепатэктомия | 24 |
| Правосторонняя гемигепатэктомия и резекция диафрагмы | 2 |
| Правосторонняя гемигепатэктомия и удаление правого надпочечника | 1 |
| Правосторонняя гемигепатэктомия и экономная резекция левой доли печени | 1 |
| Правосторонняя гемигепатэктомия, экономная резекция левой доли печени правосторонняя гемиколэктомия | 1 |
| Правосторонняя гемигепатэктомия и удаление лимфоузлов из ворот печени | 2 |
| Правосторонняя гемигепатэктомия и резекция сигмовидной кишки | 1 |
| Левосторонняя гемигепатэктомия | 5 |
| Левосторонняя гемигепатэктомия и удаление лимфоузлов ворот печени | 1 |
| Левосторонняя гемигепатэктомия, удаление рецидивной опухоли прямой кишки, экономная резекция правой доли печени, забрюшинная лимфаденэктомия | 1 |
| Всего | 43 |
Таблица 7.
Объем оперативных вмешательств у больных метастазами рака толстой кишки (экономные резекции).
| Объем операции | Число |
|---|---|
| Экономные резекции печени в пределах одной доли | 21 |
| Экономная резекция опухоли на границе долей | 8 |
| Экономная резекция обоих долей | 8 |
| Экономная резекция печени и внутрибрюшная резекция прямой кишки | 4 |
| Экономная резекция печени и правосторонняя гемиколэктомия | 4 |
| Экономная резекция печени и резекция сигмовидной кишки | 1 |
| Экономная резекция печени и резекция диафрагмы | 1 |
| Экономная резекция печени и экстирпация анастомоза | 1 |
| Экономная резекция на границе долей и удаление лимфоузлов из ворот печени | 1 |
| Экономная резекция печени и резекция правого легкого | 1 |
| Экономная резекция обеих долей и резекция тонкой кишки. | 1 |
| Всего | 51 |
Наличие внепеченочных метастазов не являлось абсолютным противопоказанием к операции на печени, хотя и относится к неблагоприятным прогностическим факторам.
У 37 больного метастазы в печень выявлены одновременно с первичной опухолью. У 11 больных данной группы резекция произведена одномоментно с удалением первичного очага. У остальных (25 человек) операция на печени выполнена во II-ой этап. В настоящее время нами отдается предпочтение одноэтапным операциям, причем у некоторых больных одноэтапно возможно выполнение даже обширных резекций печени.
Значительные трудности возникают при выборе объема операции у больных с небольшими метастатическими узлами, расположенными на границе долей. Выполнение обширных резекций печени у больных данной группы является крайне рискованным из-за высокой вероятности развития печеночной недостаточности, т.к. приходится удалять большой объем нормальной ткани печени. У 8 больных нам удалось выполнить экономные резекции печени, что во многом обусловлено использованием интраоперационного УЗКТ.
Трехлетняя выживаемость среди всех больных, подвергшихся резекции печени по поводу метастазов колоректального рака, составила 47%. Пятилетняя выживаемость - 27,3%.
Нами проведен анализ 3-х летней выживаемости после резекции печени с учетом наиболее значимых факторов прогноза (Таблица 8).
Таблица 8.
Факторы прогноза у больных подвергшихся резекции печени по поводу метастазов колоректального рака.
| Факторы прогноза | Трехлетняя выживаемость (%) |
|---|---|
| Синхронные метастазы Метохронные метастазы |
35,7 45,0 |
| Поражение одной доли Поражение двух долей |
56,5 0 |
| Метастазы только в печень Метастазы в печень и внепеченочные метастазы |
44,8 20,0 |
| Солитарные метастазы Единичные и множественные метастазы |
57,0 25,0 |
| Обширные резекции печени Экономные резекции печени |
55,5 25,0 |
Из представленной таблицы видно, что благоприятными прогностическими факторами являются: поражение одной доли, отсутствие внепеченочных метастазов, солитарный характер поражения печени, срок выявление метастаза в печень после удаления первичного очага. Нами получены лучшие результаты трехлетней выживаемости у больных, перенесших обширные резекции печени (55,5%) по сравнению с экономными резекциями печени (25%). Это подтверждает данные литературы (6), что одним из важнейших прогностических факторов является расстояние между опухолью и линией резекции печени.
Одним из путей улучшения отдаленных результатов у данной группы больных является проведение адъювантной химиотерапии. В мире накоплен большой опыт по адъювантной химиотерапии после удаления первичного очага при раке толстой кишки. Поскольку главным препаратом для лечения диссеминированных больных остается фторурацил, он и применяется в большинстве рандомизированных исследованиях. Однако целесообразность проведения адъювантной химиотерапии после удаления метастазов в печень изучена недостаточно.
С 1997г всем больным, перенесшим резекция печени по поводу метастазов колоректального рака, нами проводится 3 курса адъювантной химиотерапии. Первый курс проводится в виде 96 часовой внутриартериальной инфузии 5-фторурацила (600мг/м2 в сутки). Лейковорин 100мг/м2 в сутки 4 дня струйно внутриартериально. Реаферон по 3 млн. Ед подкожно 3 раза в неделю в течение 2 недель. Второй и третий курсы проводятся системно с использованием тех же препаратов с интервалом 4 недели. По данной схеме нами проведено 22 больных.
Учитывая отсутствие определяемых узлов, основными критериями эффективности проводимой адъювантной химиотерапии является продолжительность жизни больных и уровень опухолевого маркера в крови (РЭА).
Средний уровень опухолевого маркера до операции составил 146,2 ± 17,7 нг/мл. После удаления метастазов и проведенной химиотерапии он снизился в среднем до 8,6 ± 1,7 нг/мл.
Все 12 больных, получавших послеоперационную химиотерапию 1-1,5 года назад, к настоящему времени живы. Тогда как среди больных, не получавших адъювантную химиотерапию, 1 год прожили 89% больных. Однако вопрос целесообразности проведения адъювантной химиотерапии требует дальнейшего изучения.
Приведенные данные позволяют сделать следующие выводы:
Хирургическое лечение метастазов неколоректального рака в печень.
В литературе не нашли широкого обсуждения вопросы целесообразности хирургического лечения метастазов неколоректального рака в печень. Все исследования носят ретроспективный характер и базируются на небольшом количестве наблюдений.
За период с 1990 г. нами проведено хирургическое лечение по поводу метастазов неколоректального рака в печень 46 больным. Локализация первичной опухоли: яичники, яичко - 9 больных (19,6%); желудок, поджелудочная железа, фатеров сосок - 10 (21,7%); молочная железа - 4 (8,7%); почка, надпочечник - 7 (15,2%), печень, желчный пузырь - 7 (15,2%); карциноид -6 (13,0%); не выявленный первичный очаг - 2 (4,3%); миксоидная липосаркома бедра - 1 (2,2%) (Таблица 9).
Таблица 9.
Хирургическое и комбинированное лечение метастазов неколоректального рака в печень.
| Первичная локализация опухоли | Объем операции | ||
|---|---|---|---|
| Обширные резекции | Экономные резекции | Всего | |
| Печень, желчный пузырь | 1 | 8 | 9 |
| Яичник, яичко | 2 | 7 | 9 |
| Почка, надпочечник | 2 | 5 | 7 |
| Желудок, поджелудочная железа | - | 10 | 10 |
| Карциноид | 3 | 3 | 6 |
| Молочная железа | 1 | 3 | 4 |
| Прочие локализации | 1 | 2 | 3 |
| Всего | 10 | 36 | 46 |
Хирургическое лечение в чистом виде произведено 21 больному (45,6%), хирургическое лечение в плане комбинированной терапии - у 25 больных (54,3%). Одномоментное удаление первичной опухоли с резекцией печени произведено у 13 больных (28,3%). У 31 больного (67,4%) выполнена резекция печени по поводу метастазов после удаления первичной опухоли. Сроки от удаления первичной опухоли до выявления метастазов в печень: до года - 28% больных; до 2-х лет - 12 % больных; более 2-х лет - 18% больных. Объем операций на печени представлен в таблице №9. Повторные резекции печени выполнены у 4 больных (9,3%).
Проведено изучение отдаленных результатов лечения этих больных. На основании полученных данных больные были разбиты на три группы: