14.05.2020
Е.А. Горбунова2, Р.А. Зуков1,2, Н.Н. Медведева1
Резюме. В статье представлен обзор литературы по проблеме диагностики и коррекции нутритивной недостаточности у больных раком желудка. Недостаточность питания у больных раком желудка приводит к ухудшению качества жизни пациентов, увеличению числа послеоперационных осложнений, увеличению послеоперационной летальности. Проанализирована безопасность и эффективность влияния энтеральной нутритивной поддержки на течение послеоперационного периода у больных раком желудка. Оценка нутритивного статуса больных раком желудка на всех этапах лечения пациента и своевременная коррекция риска развития недостаточности питания, активная персонализированная нутритивная поддержка пациентов с диагностированной нутритивной недостаточностью – обязательный элемент современного лечения рака желудка.
Ключевые слова: рак желудка, нутритивный статус, нутритивная недостаточность, нутритивная поддержка, индекс массы тела (ИМТ), послеоперационные осложнения.
Введение
Рак желудка (РЖ) является актуальной проблемой онкологии. На сегодняшний день в мире регистрируются высокие показатели заболеваемости и смертности от данного заболевания [1]. Количество впервые выявленных случаев РЖ в 2018 году по данным ВОЗ составило более 1 миллиона, без существенной динамики по сравнению с данными 2012 года. В структуре общей онкологической заболеваемости занимает устойчивое 5 место. Более половины впервые диагностированных случаев заболевания зарегистрировано в странах Азии (75,4%). В структуре смертности от онкологических заболеваний РЖ занимает 3 место. Несмотря на успехи современной медицины, внедрение высокоинформативных методов диагностики, таргетной терапии, ежегодно в мире от данной опухоли продолжают погибать около 800000 человек. Стандартизированные по возрасту показатели заболеваемости у мужчин в 2 раза выше, чем у женщин [1]. В России в 2017 году выявлено около 35000 новых случаев заболеваемости РЖ, при этом у большинства пациентов заболевание было диагностировано в стадии местного и отдаленного распространения (III стадия – 23,8%, IV стадия – 39,9%) [2]. В Красноярском крае в 2017 году диагноз РЖ был впервые установлен 725 пациентам. Летальность на первом году заболевания с момента установления диагноза составила 44,2% [2].
Согласно практическим рекомендациям RUSSCO по лекарственному лечению РЖ, выбор тактики лечения определяется степенью распространенности опухолевого процесса и функциональным состоянием пациента. Основным методом радикального лечения РЖ является хирургическое вмешательство, дополняемое в большинстве случаев системной противоопухолевой терапией [3, 4].
Нутритивная недостаточность у больных раком желудка не всегда позволяет провести лечение в полном объеме [5, 6].
Европейским обществом по клиническому питанию (European Society for Clinical Nutrition and Metabolism, ESPEN, 2015) нутритивной недостаточностью называется состояние, при котором в результате недостаточного поступления в организм или усвоения в нем питательных веществ отмечаются изменения в компонентном составе организма, в частности, снижение тощей массы тела, приводящие к нарушению физических и психических функций организма, ухудшающие клинический исход заболевания. По результатам исследования ECOG в 2003 г., включавшего 3047 онкологических больных, выявлено, что частота нутритивной недостаточности при опухолевом поражении органов желудочно-кишечного тракта (ЖКТ) колеблется от 70 до 83%. Наиболее часто нутритивная недостаточность встречается при раке желудка и пищевода (75-80%) [5].
Для улучшения результатов лечения рака желудка, снижения частоты развития послеоперационных осложнений, профилактики рецидивов заболевания, повышения качества жизни пациентов важную роль играет поддерживающая терапия, в частности, снижение риска развития недостаточности питания, адекватная и своевременная нутритивная поддержка [7-10].
Отсутствие персонифицированного подхода к коррекции нутритивного статуса у больных раком желудка остается одной из важных нерешенных проблем мирового сообщества на сегодняшний день [9, 11].
Оценка нутритивного статуса
Для определения недостаточности питания необходимо оценивать нутритивный статус пациента [9, 12-14]. Оценка нутритивного статуса базируется на определении антропометрических, лабораторных и морфофункциональных критериев [15]. Для определения риска развития нутритивной недостаточности используются различные скрининговые шкалы [16]. Для больных раком желудка, которым планируется оперативное лечение, Европейским обществом клинического питания и метаболизма (ESPEN) рекомендован скрининг нутритивного статуса по шкале «Оценка нутритивного риска» (Nutritional Risk Screening) NRS 2002. Данная шкала состоит из двух блоков – предварительного скрининга и финальной оценки недостаточности питания [17-19].
Шкала NRS 2002

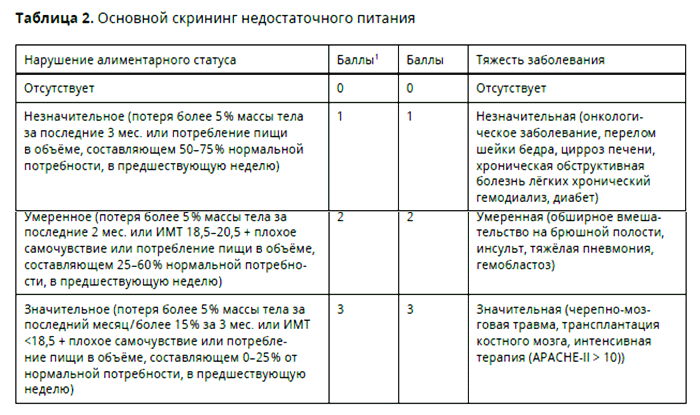
Баллы из левой и правой колонок суммируются. У пациентов в возрасте ≥70 лет к полученной сумме прибавляется 1 балл. При итоговом количестве баллов ≥3 имеется риск недостаточности питания, необходимо проведение нутритивной поддержки. Если количество баллов <3 – рекомендуется проведение еженедельного скрининга. При планировании серьезной операции необходимо соблюдать план профилактического питания [18]. Таким образом, нутритивная поддержка с применением сипинга может быть рекомендована пациентам, которым планируется обширное оперативное вмешательство при наличии умеренного нарушения нутритивного статуса (потеря >5% массы тела за последние 2 мес. или ИМТ 18,5-20,5 в сочетании с плохим самочувствием или потребление пищи в объеме 25-60% от нормальной потребности за последние 7 дней).
В 2018 г. ESPEN и ASPEN (Американской ассоциацией парентерального и энтерального питания) также были предложены критерии оценки недостаточности питания GLIM (Global Leadership Initiative on Malnutrition).
Лабораторные методы оценки нутритивного статуса позволяют определить степень нутритивной недостаточности: легкую, среднюю, тяжелую.
Таблица 3. Оценка степени нутритивной недостаточности [20].
| Показатели крови | Степень нутритивной недостаточности | ||
|---|---|---|---|
| Легкая | Средняя | Тяжелая | |
| Общий белок, г/л | 60-55 | 55-50 | <50 |
| Альбумин, г/л | 35-30 | 30-25 | <25 |
| Лимфоциты, клеток в мкл | 1800-1500 | 1500-800 | <800 |
Период полураспада трансферрина значительно меньше, чем у альбумина, поэтому на ранних сроках после оперативного лечения предпочтительнее ориентироваться на уровень трансферрина. Однако при наличии у пациента железодефицитной анемии необходимо учитывать компенсаторное увеличение значения трансферрина в крови. Наибольшей информативностью в оценке нутритивного статуса обладают транспортные белки с незначительным периодом полураспада – преальбумины: тироксинсвязывающий белок (ТСПА, транстиретин) и ретинолсвязывающий белок (РСБ) [15]. Известно, что гипальбуминемия – широко используемый показатель нутритивной недостаточности и является предиктором послеоперационных осложнений и худшей выживаемости при раке желудка [21]. При уровне альбумина менее 25 г/л значительно уменьшается терапевтический эффект применяемых лекарственных средств, увеличивается риск побочных эффектов, вероятность послеоперационных осложнений может возрастать в 4 раза, а смертность – в 6 раз [6, 15].
Описанные выше белковые показатели и лимфоциты наиболее часто используются для оценки нутритивного статуса в клинической практике.
Также для оценки нутритивной недостаточности можно использовать индекс нутритивного риска (ИНР), предложенный еще в 80-х гг. Buzby G.P., который рассчитывается по формуле: ИНР = 1,519 × уровень альбумина (г/л) × (масса тела (кг) исходная / масса тела в настоящий момент) и интерпретируется следующим образом: ИНР >97,5 – нет нутритивной недостаточности; ИНР от 83,5 до 97,5 – средняя степень недостаточности питания; ИНР <83,5 – тяжелая степень недостаточности питания [6].
В 1984 г. индекс модифицирован Onodera и основывается на определении уровня альбумина и лимфоцитов в периферической крови. Так называемый прогностический нутритивный индекс (PNI). PNI рассчитывается по формуле: PNI = уровень альбумина (г/л) + 0,005 × общее число лимфоцитов (клеток в мкл), cut-off значения PNI варьируют. Так, при раке желудка в исследовании Sakurai K. с соавт. (2016) PNI ≤43,8 являлся независимым прогностическим фактором худшей 5-летней общей выживаемости [22]. Известно также, что данный индекс является независимым прогностическим фактором развития послеоперационных осложнений хирургического лечения рака желудка, а также у пациентов с диссеминированным процессом [23-25]. В исследовании Nie R. с соавт. (2016) на примере 660 больных диссеминированным раком желудка показано, что среди пациентов с более высоким прогностическим нутритивным индексом показатели общей выживаемости были значительно выше, чем в группе с низким прогностическим нутритивным индексом (13,13 против 9,03 месяца, р<0,001) [26].
Патогенез недостаточности питания
В патогенезе нутритивной недостаточности можно выделить 3 основных синдрома, которые тесно связаны и зачастую неотделимы друг от друга: синдром анорексии кахексии, синдром гиперкатаболизма-гиперметаболизма, синдром кишечной недостаточности [14].
Основные причины снижения потребления пищи при раке желудка включают в себя: мукозиты, ксеростомию, плохое состояние зубов, опухолевый стеноз просвета желудка, мальабсорбцию, запор, диарею, тошноту, рвоту, снижение моторики кишечника, хемосенсорное изменение, боль в теле и побочные эффекты лекарственной терапии. Прогрессирующая потеря мышечной массы, в результате снижения количества потребляемой пищи и дисбаланса метаболических процессов в организме, гиперкатаболизма, гипоанаболизма, представляет собой синдром анорексии-кахексии у онкологических больных (САКОБ), который может являться непосредственной причиной смерти у 20% онкологических пациентов [14, 27]. Исследование, проведенное в 2017 году в Национальном институте рака в Мексике, показало, что синдром анорексии-кахексии среди паллиативных пациентов наиболее часто развивается у больных раком желудка [28].
У здорового пациента низкий уровень лептина в головном мозге увеличивает активность гипоталамических орексигенов и стимулирует аппетит [29]. У больных раком желудка в сыворотке крови повышенные уровни цитокинов, участвующих в распознавании опухолевых клеток, формировании противоопухолевого иммунитета, а также способствующих росту и васкуляризации опухоли, маскируются под лептин и активируют анорексигенные гормоны, блокируя нейропептид Y, что в итоге приводит к снижению аппетита и потере массы тела. Также под действием цитокинов происходит постоянная активация убиквитина, который приводит к деградации белка мышечной ткани у больных раком желудка [14].
Особенностью синдрома гиперкатаболизма-гиперметаболизма является несоответствие между потребностью организма в белке и энергии и потреблением белка и энергии. Усиливается распад белков, увеличивается энергопотребность, снижается скорость окисления глюкозы, увеличивается скорость окисления липидов, что приводит к развитию патологической толерантности организма к натуральным (естественным) продуктам. Недостаточность макронутриентов и микронутриентов ведет к освобождению собственных резервов за счет деструкции тканей организма («аутоканнибализм») [14, 15].
Оперативное лечение РЖ приводит к высвобождению стрессовых гормонов и медиаторов воспаления, ведущих к формированию синдрома системной воспалительной реакции, к метаболической дезорганизации организма [15, 30]. Увеличиваются энергозатраты организма, соответственно увеличиваются потери азота. Потеря 1 грамма азота организмом в условиях стресс-голодания равнозначна потери 25 г собственной мышечной массы (аутоканнибализм) [15]. Выраженный отрицательный азотистый баланс на фоне недостаточного поступления белка извне, продолжающийся более 2-3 недель, способен привести к прогрессированию полиорганной недостаточности и смерти пациента [31].
В своем исследовании Buzby G.P. с соавт (1980) показали, что у пациентов с нутритивной недостаточностью послеоперационные осложнения возникали в 6 раз чаще, а послеоперационная летальность – в 11 раз, по сравнению с пациентами с нормальным нутритивным статусом [6]. Проблема питания больных раком желудка актуальна и на сегодняшний день [32].
Нутритивная поддержка больных раком желудка
Одно из неотъемлемых направлений поддерживающей терапии у больных раком желудка – нутритивная поддержка пациентов [10, 31, 33].
При выборе метода нутритивной поддержки необходимо придерживаться основного принципа: «Если ЖКТ работает, используй его, а если нет – заставь его работать!» Предпочтение следует отдавать более физиологическому энтеральному питанию и только при его невозможности применять парентеральное или смешанное питание [15, 34-36]. В исследовании Zhi-hua Chen с соавт. (2017) пациенты с опухолевой обструкцией желудка на дооперационном этапе получали энтеральное питание через назо-интестинальный зонд. В группе, где пациенты получали энтеральную нутритивную поддержку, по сравнению с пациентами, которым осуществлялась только парентеральная нутритивная поддержка, наблюдалось меньшее количество послеоперационных осложнений, более ранняя активация моторики толстого кишечника, более быстрое восстановление после оперативного вмешательства [34]. Согласно рекомендациям ESPEN (2017), нутритивную поддержку следует начинать, если у пациента имеется нутритивная недостаточность или риск ее развития или ожидается, что пациент не сможет питаться обычным путем более 7 сут. или что прием пищи будет недостаточным (менее 60% от суточной потребности) более 1-2 недель [31].
Предоперационная нутритивная поддержка
Предоперационная нутритивная поддержка у больных раком желудка способствует улучшению нутритивного статуса пациентов, а также снижению количества осложнений и их тяжести в послеоперационном периоде [8, 34, 37]. В проспективном рандомизированном контролируемом исследовании Kabata P. с соавт. (2015) с участием 102 пациентов исходно без признаков недостаточности питания (альбумин >35 г/л, потеря веса <10% за 6 мес.) с опухолями брюшной полости (преимущественно желудок и прямая кишка) было показано, что в группе пациентов, которым в течение 14 дней до операции проводилась нутритивная поддержка с применением сипинга (Нутридринк компакт протеин по 2 бутылочки в день), по сравнению с контрольной группой (обычная диета без применения специализированного питания) в 2 раза реже развивались осложнения (p<0,001) в послеоперационном периоде, тяжесть осложнений была меньше [38].
Показаниями к проведению предоперационной нутритивной поддержки, согласно рекомендациям RUSSCO (2019), являются [39]:
При сохранении возможности перорального приема пищи применяют готовые сбалансированные смеси для перорального приема (сипинг) в дозе 600-900 ккал/сут. (например, 2-3 бутылочки Нутридринк компакт протеин, производитель «Нутриция»). При невозможности перорального приема пищи (стеноз желудка) проводят зондовое, парентеральное или смешанное питание согласно расчетной суточной потребности (например, Нутризон Эдванст Протизон, производитель «Нутриция»). Оптимальные сроки предоперационной нутритивной поддержки должны составлять не менее 7-14 дней [31, 40, 41].
Послеоперационная нутритивная поддержка
Ранняя послеоперационная энетральная нутритивная поддержка позволяет компенсировать высокий метаболизм, вызванный хирургической травмой, поддерживать барьерную функцию слизистой оболочки кишечника, предотвращать энтерогенные инфекции, снижает частоту инфекционных осложнений в послеоперационном периоде и длительность госпитализации, ускоряя выздоровление пациентов [9, 33, 39, 42-45]. Начало зондового энтерального питания рекомендуется через сутки после оперативного вмешательства со скоростью 25 мл/час с доведением до необходимого объема питания в течение 24-48 часов [39]. При недостаточном восполнении потребностей рекомендуется применение смешенного питания (энтеральное + парентеральное) с последующим переходом на пероральное питание с добавлением сипинга. По данным Хомякова В.М. с соавт. (2016), при гастрэктомии рекомендуется следующий алгоритм нутритивной поддержки в послеоперационном периоде: в 1-е сутки – зондовое питание – 400 мл полуэлементной питательной смеси (например, Нутризон Эдванст Пептисорб) 30 мл/ч + парентеральное питание до общей калорийности 1800-2000 ккал; на 2-е сутки – 800 мл питательной смеси 50 мл/ч + парентеральное питание до общей калорийности 1800-2000 ккал; на 3-4-е сутки – 1200 мл полимерной смеси (например, Нутризон Эдванст Протизон) 70 мл/ч + в/в введение кристаллоидов; 5-е сутки (контроль анастомоза) – стол 0 + сипинг + в/в введение кристаллоидов; с 6-7-х суток – пероральное питание в полном объеме + сипинг, отмена инфузионной терапии [5].
Нутритивная поддержка при химиотерапии и лучевой терапии
Химиотерапия может приводить к развитию анорексии вследствие изменения вкуса и обоняния, появления металлического привкуса, дисфагии, язв на слизистой губ, языка, ротовой полости и пищевода, тошноты, рвоты, запоров или паралитического илеуса. Проведение лучевой терапии может приводить к развитию мукозитов, что также может негативно отражаться на нутритивном статусе пациентов. Следует относиться к нутритивной поддержке в процессе химио- и лучевой терапии не как к опции, а как к обязательному компоненту лечения данной категории больных. Нутритивную поддержку следует начинать как можно раньше (при наличии показаний), поскольку при легкой степени питательной недостаточности гораздо проще стабилизировать нутритивный статус и предотвратить тяжелое истощение вследствие прогрессирования катаболизма [39].
Нутритивная поддержка занимает особое место в паллиативной помощи больным раком желудка. Учитывая, что при метастатическом раке желудка процесс развития синдрома кахексии-анорексии протекает стремительнее, необходимо максимально отсрочить развитие необратимой, рефрактерной кахексии, придерживаясь принципа: «легче предупредить, чем лечить» [31, 46-48].
Выбор смесей для энтерального питания многообразен. В качестве стандартных питательных смесей у больных раком желудка предпочтение необходимо отдавать полимерным сбалансированным смесям с высоким содержанием белка. Согласно последним рекомендациям ESPEN (2017), потребность в белке у пациентов с онкологическими заболеваниями практически в 2 раза выше таковой у здоровых и составляет 1,5 г/кг массы тела в сутки [31]. Поэтому при наличии у пациента недостаточности питания или риске ее развития необходимо применение смесей с высоким содержанием белка. Примером высокобелковой смеси для сипинга, специально разработанной для пациентов с онкологическими заболеваниями, является Нутридринк Компакт Протеин (производитель «Нутриция»), в одной бутылочке которого содержится 18 г белка и 300 ккал энергии. При наличии у пациентов метаболических нарушений (сахарный диабет / стрессовая гипергликемия, почечная, печеночная или дыхательная недостаточность) для обеспечения адекватной нутритивной поддержки целесообразно использовать метаболически направленные смеси. Так, при нарушении углеводного обмена у онкологических пациентов рекомендуется использовать смеси типа «Диабет» с высоким содержанием белка (Нутризон Эдванст Диазон HEHP, производитель «Нутриция») [15].
Учитывая разнообразие современного клинического питания, важен персонифицированный подход к оказанию нутритивной поддержки больных раком желудка. Довольно часто среди больных раком желудка встречается инверсия вкуса, которая может проявляться в виде снижения или усиления восприятия вкусов. Инверсия вкуса может встречаться в 70% случаев при проведении химиотерапии и/или лучевой терапии [49]. Наличие у пациента нарушений восприятия вкуса может значительно ухудшать его нутритивный статус, что, в свою очередь, может негативно повлиять на переносимость и результаты противоопухолевого лечения [50]. Сегодня с появлением на рынке смесей Нутридринк компакт протеин с сенсорным компонентом стал возможным дифференцированный подход к выбору смеси у пациентов с инверсией вкуса. При снижении восприятия вкусов на фоне лекарственной терапии может помочь смесь с согревающим вкусом, которая за счет активации соматосенсорной системы тройничного нерва позволяет делать восприятие вкусов пищи более ярким. Сенсорные нарушения, такие как ощущение жжения на фоне лучевой терапии, можно облегчить применением смеси с охлаждающим эффектом. Применение нейтрального вкуса может уменьшить дополнительные раздражители и снизить неприятные вкусовые ощущения во рту у пациентов с усилением восприятия вкусов [51].
Заключение
Больные раком желудка с нутритивной недостаточностью или риском ее развития, с исходно низким индексом массы тела находятся в группе риска по развитию послеоперационных осложнений, послеоперационной летальности [6, 23-26, 52].
На сегодняшний день многочисленными исследованиями доказана эффективность и безопасность энтеральной нутритивной поддержки у больных раком желудка. Важно подготовить организм больного к предстоящей операции, к стресс-реакции, которая неизбежно последует за оперативным вмешательством. В клинических рекомендациях, утвержденных министерством здравоохранения Российской Федерации по раку желудка, подчеркивается необходимость оценки нутритивного статуса на этапе обследования пациента.
Нутритивная поддержка должна быть неотъемлемой частью лечения рака желудка. При выявлении у больного раком желудка на любом этапе лечения нутритивной недостаточности или риска ее развития необходимо как можно раньше начать проведение нутритивной поддержки. Применение нутритивной поддержки позволяет снизить частоту развития послеоперационных осложнений, сократить сроки госпитализации, улучшить непосредственные и отдаленные результаты противоопухолевого лечения.
Широкий выбор смесей для энтерального питания позволяет дифференцированно подходить к выбору специализированных лечебных смесей, не только учитывая метаболические нарушения, но и развивающуюся в ряде случаев инверсию вкуса.
Литература:
Материал предоставлен компанией «Nutricia Specialized Nutrition». Публикуется без изменений, в редакции авторов.