18.03.2019
В декабре 2018 года на ежегодном симпозиуме, посвященном вопросам диагностики и лечения рака молочной железы в Сан-Антонио – San Antonio Breast Cancer Symposium (SABCS) 2018, были представлены обновленные данные международного клинического исследования III фазы по оценке эффективности и безопасности ингибитора PI3K альпелисиба в сочетании с фулвестрантом в 1 и 2 линиях терапии у пациентов с HR+ HER2- распространенным раком молочной железы (HR+ HER2- рРМЖ) – SOLAR-1.
Эндокринная терапия (ЭТ) является основной опцией для лечения пациентов с гормонозависимыми подтипами РМЖ. Клиническую пользу от применения препаратов, контролирующих продукцию эстрогена и/или прогестерона, получают ≈50% больных с HR+ HER2- рРМЖ [1]. Однако значимая часть пациентов прогрессирует при использовании различных вариантов эндокринной терапии, что существенно ограничивает возможности дальнейшего лечения, прямо влияет на исходы терапии и снижает качество жизни.
Развитие резистентности к ЭТ обусловлено взаимодействием множества молекулярных каскадов, вовлеченных в процессы роста и развития опухоли [1]. Так, нарушение регуляции сигнального каскада PI3K-Akt-mTOR наблюдается в более 70% случаев РМЖ. Одной из причин патологической активации сигнального пути PI3K-Akt-mTOR является мутация гена PIK3CA, кодирующего фосфатидил-инозитол-3-киназу (PI3K). Мутация гена PIK3CA распространена в 40% случаев HR+ HER2- рРМЖ и определяет резистентность опухоли к ЭТ [2]. Выявление клинической значимости мутации PIK3CA определило разработку таргетных препаратов, направленных на инактивацию PI3K.
Альпелисиб – специфичный ингибитор каталитической α-субъединицы PI3K, участвующей в патологической активации молекулярного каскада PI3K-mTOR-Akt, связанной с рефрактерностью РМЖ к ЭТ [2,3].
Эффективность и безопасность альпелисиба была изучена в международном исследовании III фазы SOLAR-1. Первые данные исследования были представлены в октябре 2018 года на конгрессе Европейского общества медицинской онкологии (ESMO) [3].
В исследовании SOLAR-1 пациенты были разделены на 2 подгруппы: с наличием мутации PIK3CA (PIK3CA mut) и с PIK3CA дикого типа (PIK3CA wt), после рандомизированы на получение комбинации альпелисиба в сочетании с фулвестрантом или плацебо в сочетании с фулвестрантом.
В исследование пациенты включались по следующим критериям:
Первичной конечной точкой исследования стала оценка показателя выживаемости без прогрессирования (ВБП) в подгруппе пациентов с мутацией PIK3CA [3].
Эффективность применения альпелисиба в сочетании с фулвестрантом была доказана для группы пациентов, резистентных к ЭТ c мутацией PIK3CA (рис.1) [3]. Выигрыш в медиане ВБП совместно со снижением риска рецидива на 52% (95% ДИ; ОР=0,48) по сравнению с применением плацебо в сочетании с фулвестрантом наблюдался у всех пациентов с мутацией PIK3CA [3].
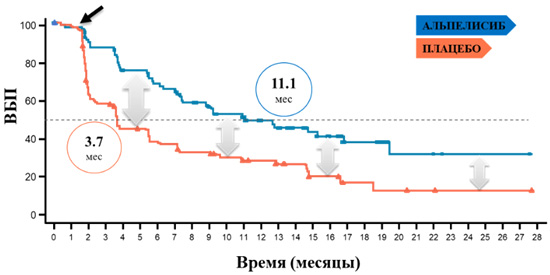
Рисунок 1. ВБП у пациентов с мутацией PIK3CA при терапии комбинациями
альпелисиб + фулвестрант vs плацебо + фулвестрант (BIRC).
Для пациентов без мутации PIK3CA показатели эффективности были сопоставимы в обеих группах сравнения (табл.1) [3].
Таблица 1. Медиана ВБП у пациентов с диким типом PIK3CA, получающих терапию
альпелисибом с фулвестрантом или плацебо с фулвестрантом.
| PIK3CA wt пациенты | ||
|---|---|---|
| Альпелисиб + фулвестрант | Плацебо + фулвестрант | |
| мВБП (месяцы) | 7,4 | 5,6 |
| ОР (95% ДИ) | 0,85 | |
В рамках ежегодного симпозиума SABCS 2018 были представлены более зрелые результаты исследования SOLAR-1 по оценке динамики изменения диаметров таргетных очагов, подгрупповому анализу эффективности применения комбинации альпелисиба в сочетании с фулвестрантом у пациентов с мутацией PIK3CA, сопоставимости различных методов определения мутации и обновленные результаты профиля безопасности [2].
Максимальный процент уменьшения суммы диаметров таргетных очагов от исходной у пациентов с мутацией PIK3CA в группе терапии альпелисибом составил 76%, в сравнении с 44% в группе применения фулвестранта в режиме монотерапии [2].
Подгрупповой анализ эффективности применения комбинации альпелисиба с фулвестрантом у пациентов с мутацией PIK3CA
Преимущество комбинации альпелисиба с фулвестрантом по сравнению с терапией фулвестрантом было доказано как в 1-й (ОР=0,71), так и во 2-й (ОР=0,61) линиях терапии у пациентов HR+ HER2- рРМЖ (рис.2) [2].
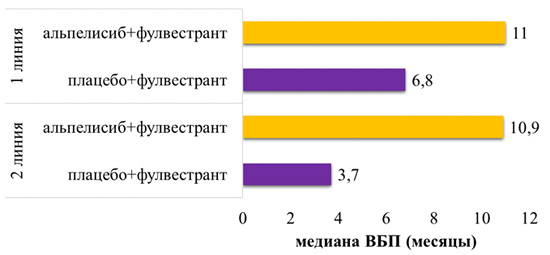
Рисунок 2. Медиана ВБП у пациентов с мутацией PIK3CA в зависимости от линии терапии.
Преимущество группы альпелисиб+фулвестрант в сравнении с плацебо+фулвестрант сохранялось у пациентов c первичной резистентностью к ЭТ при снижении риска прогрессирования на 31% (95% ДИ, ОР=0,69) (рис.3) [2].
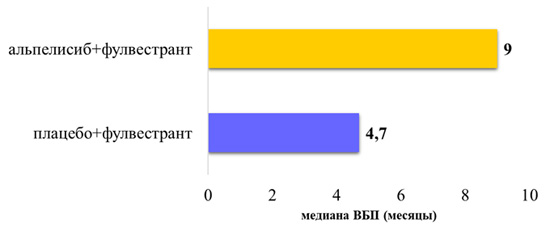
Рисунок 3. Медиана ВБП у пациентов с первичной резистентностью к ЭТ и мутацией PIK3CA.
Оценка сопоставимости определения мутации в гене PIK3CA из ДНК, полученной методами жидкостной и тканевой биопсий
Анализ валидности определения мутации в гене PIK3CA по циркулирующей опухолевой ДНК плазмы крови показал клиническую обоснованность и сопоставимость с тканевой биопсией [2].
| Альпелисиб + фулвестрант | Плацебо + фулвестрант | ОР | |||
|---|---|---|---|---|---|
| События n/N (%) | мВБП (мес.) | События n/N (%) | мВБП (мес.) | ||
| PIK3CA mut пациенты: тканевая биопсия | 103/169 (60,9) | 11,0 | 129/172 (75,0) | 5,7 | 0,65 |
| PIK3CA mut пациенты: жидкостная биопсия | 57/92 (62,0) | 10,9 | 75/94 (79,8) | 3,7 | 0,55 |
| PIK3CA wt пациенты: тканевая биопсия | 49/115 (42,6) | 7,4 | 57/116 (49,1) | 5,6 | 0,85 |
| PIK3CA wt пациенты: жидкостная биопсия | 92/181 (50,8) | 8,8 | 103/182 (56,6) | 7,3 | 0,80 |
Безопасность применения комбинации альпелисиба с фулвестрантом
В группе пациентов с мутацией PIK3CA наиболее часто встречающимися нежелательными явлениями (НЯ) 3 и 4 степеней тяжести на фоне применения комбинации альпелисиба с фулвестрантом были гипергликемия (36,7% vs 0,6%), сыпь (13% vs 0,6%) и диарея (7,7% vs 0,6%) [2,3]. При этом отмена терапии в связи с развитием НЯ была зарегистрирована у 3% пациентов группы альпелисиб + фулвестрант в сравнении с 2% в группе плацебо + фулвестрант [2,3].
Обратимая гипергликемия – основное НЯ на фоне применения ингибиторов PI3K, обусловленная ролью PI3K как медиатора активации функции инсулина [2-4].
В исследовании SOLAR-1 наибольшая вероятность отклонения уровня глюкозы в плазме наблюдалась в первые 2 недели терапии и далее снижалась к исходному уровню (рис.4) [2]. У 87% пациентов с развившейся гипергликемией уровень сахара крови корректировался противодиабетическими средствами. В подавляющем большинстве – метформином (76% пациентов) [2]. Наличие у пациентов сахарного диабета не являлось критерием исключения в исследовании SOLAR-1 [2,3].
Рисунок 4. Динамика среднего изменения уровня глюкозы в плазме
в зависимости от исходных характеристик пациентов.
Альпелисиб – первый ингибитор PI3K, который продемонстрировал благоприятное соотношение риск/польза у пациентов с мутацией PIK3CA HR+ HER2- рРМЖ, резистентных к ЭТ (групп исходной и вторичной резистентности).
В рамках исследования SOLAR-1 было доказано, что для определения мутации в гене PIK3CA применима ДНК, выделенная как из образцов опухолевой ткани, так и из плазмы крови пациента.
Литература:
1099991/onco/html/01.19/1