Тюляндин С.А.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Введение. Рак пищевода относится к наименее изученным и наиболее неблагоприятным по течению злокачественным опухолям. За последние годы прогресс в области диагностики, стадирования и лечения позволил несколько улучшить результаты лечения больных этой формой опухоли. Хирургия остается самым эффективным методом лечения больных раком пищевода [1]. Частота радикальных резекций при выполнении трансторакальной эзофагэктомии составляет 60-90%, послеоперационная летальность - 1,5-23%, а 5-летняя выживаемость – 10-25%. Отдаленные результаты хирургического лечения, в первую очередь, определяются распространенностью опухолевого процесса. Если при I стадии 5-летняя выживаемость составляет более 50%, то при поражении лимфоузлов средостения она падает до 10-25% (табл. 1).
Таблица 1.
Прогноз больных раком пищевода (5-летняя выживаемость) в зависимости от стадии заболевания [1].
| Стадия | TNM | 5-летняя выживаемость (%) |
|---|---|---|
| 0 | TisN0M0 | >95 |
| I | T1N0M0 | 50–80 |
| IIA | T2-3N0M0 | 30–40 |
| IIB | T1-2 N1M0 | 10–30 |
| III | T3N1M0T4NлюбаяM0 | 10–15 |
| IV | TлюбаяNлюбаяM1 | <1-2 |
Принимая во внимание тот факт, что у 75% больных рак пищевода диагностируется во II-III стадиях, вряд ли можно считать удовлетворительными показатели 5-летней выживаемости 30% и менее после хирургического лечения в самостоятельном варианте. Это делает актуальным вопрос, можно ли сегодня улучшить результаты хирургического лечения больных раком пищевода, которые погибают или от развития рецидива в средостении или от отдаленных метастазов.
Пред- и послеоперационная лучевая терапия. Оба метода широко использовались в 80-90 годах прошлого века, однако не смогли существенно улучшить результаты хирургического лечения.
Адъювантная химиотерапия. Адъювантная химиотерапия не способна улучшить результаты оперативного лечения. Общее состояние больных после перенесенной тяжелой операции и наличие сопутствующей патологии затрудняет проведение системной терапии и может быть одним из объяснений ее неудовлетворительных результатов [2]. Однако основной причиной низкой эффективности является резистентность опухолевых клеток рака пищевода к используемым лекарственным препаратам. Наиболее активными препаратами для лечения рака пищевода признаны цисплатин, 5-фторурацил, блеомицин, митомицин-С, этопозид и винка-алкалоиды. За последние годы только таксаны (паклитаксел и доцетаксел) продемонстрировали клинически значимую активность при лечении этого заболевания. Свидетельством низкой эффективности лекарственной терапии являются результаты лечения больных с метастатическим процессом, у которых при назначении вышеперечисленных препаратов частота и продолжительность объективного эффекта не превышает 20% и 2-4 месяцев соответственно и сопровождается лишь незначительным паллиативным эффектом, не приводя к увеличению продолжительности жизни.
Предоперационная химиотерапия. Целью предоперационной химиотерапии у операбельного больного является уменьшение размеров опухоли и создание условий для выполнения операции меньшего объема, а также воздействие на первичный очаг и микрометастазы для улучшения прогноза заболевания. Это послужило основанием для проведения рандомизированных исследований по изучению роли предоперационной химиотерапии у больных с операбельным раком пищевода.
В исследовании Kelsen и соавт. 440 больных плоскоклеточным раком и аденокарциномой пищевода (54% больных) получали хирургическое лечение или хирургическое лечение в сочетании с предоперационной химиотерапией (3 курса комбинацией цисплатина и инфузиями 5-фторурацила) [3]. В группе предоперационной химиотерапии при выполнении радикальной резекции опухоли дополнительно проводили еще 2 курса подобной терапии послеоперационно. Медиана продолжительности жизни в группе оперативного лечения составила 16,1 месяц, в группе предоперационной химиотерапии - 14.5 месяцев. Показатель 3-летней выживаемости составил 26% для обеих групп. Не отмечено влияния гистологического строения опухоли на результаты лечения. Частота местных рецидивов в группе оперативного лечения составила 32%, в группе предоперационной химиотерапии - 31%. Отмечена тенденция к увеличению частоты прогрессирования заболевания за счет появления отдаленных метастазов в группе больных, не получавших предоперационной химиотерапии. Предоперационная химиотерапия не увеличила частоту послеоперационных осложнений и летальности. Следует отметить низкую эффективность комбинации цисплатина и инфузий 5-фторурацила в данном исследовании, что вероятно, и послужило основной причиной негативных результатов данного исследования.
Исследователи из Великобритании представили предварительные результаты другого исследования, в которое были включены 802 больных раком пищевода различного гистологического строения [4]. Больные были рандомизированы на две группы: оперативного лечения и оперативного лечения с предоперационной химиотерапией (2 курса комбинацией цисплатина, 5-фторурацила и этопозида). Примерно 2/3 больных в каждой группе имели аденокарциному пищевода. Частота резекции составила 91% для всех больных, частота радикальной резекции (R0) составила 84% после предоперационной химиотерапии и 71% в группе оперативного лечения. Частота послеоперационных осложнений составила 48% и 41% соответственно, а показатель30-дневной послеоперационной летальности - 9% и 10%. Медиана продолжительности жизни больных, получавших предоперационную химиотерапию, была существенно больше по сравнению с группой оперативного лечения: 17,4 и 13,4 месяца. Показатели 2-летней общей выживаемости составили 45% и 35% соответственно (р.=0.002). Не отмечено влияния гистологического строения опухоли на результаты лечения.
Противоречивость полученных данных послужила причиной проведения мета-анализа всех исследований, сравнивавших эффективность предоперационной химиотерапии и оперативного лечения в самостоятельном варианте [5]. Проанализированы результаты лечения 2051 больного. В группе предоперационной химиотерапии частота объективного эффекта колебалась в разных исследованиях от 15% до 60%, полная регрессия опухоли, подтвержденная морфологически, отмечена у 4-7% больных, что сочеталось с достоверным увеличением продолжительности жизни. Проведение предоперационной химиотерапии умеренно повышало частоту выполнения радикальных резекций, но приводило к повышению послеоперационной летальности (на 3,4%) и осложнений, а также улучшало показатель 5-летней выживаемости на 6,4% по сравнению с группой хирургического лечения.
Следует признать, что современная предоперационная химиотерапия резектабельного рака пищевода пока не способна существенным образом изменить прогноз больных и улучшить результаты оперативного лечения.
Предоперационная химиолучевая терапия. Химиолучевая терапия преследует цель увеличить частоту противоопухолевого эффекта первичной опухоли и локорегиональных метастазов за счет добавления лучевой терапии и уничтожения отдаленных метастазов за счет проведения системной химиотерапии. Все вместе это должно улучшить результаты оперативного лечения.
Возможности предоперационного химиолучевого лечения изучены в многочисленных исследованиях в рамках II фазы и в 9 рандомизированных исследованиях (большинство из которых включало небольшое количество пациентов), которые вновь показали противоречивые результаты. Мета-анализ результатов лечения 1116 больных показал, что проведение предоперационной химиолучевой терапии позволяет достигнуть морфологически полной регрессии опухоли у 21% больных (что существенно больше по сравнению с предоперационной химиотерапией в самостоятельном варианте), уменьшает риск развития местного рецидива на 64% и риск смерти от прогрессирования опухоли на 34% по сравнению с группой оперативного лечения [6]. Предоперационная химиотерапия умеренно повышает частоту выполнения радикальной резекции опухоли и послеоперационную летальность.
Таким образом, предоперационная химиолучевая терапия становится все более популярным методом лечения больных операбельным раком пищевода.
Химиолучевая терапия как единственный метод лечения резектабельного рака пищевода. Можно ли отказаться от проведения оперативного лечения и использовать только консервативные методы лечения даже у операбельных больных раком пищевода? Законность постановки этого «провокационного» вопроса оправдывается неудовлетворительными отдаленными результатами хирургического лечения, высокой частотой послеоперационных осложнений и летальности.
В рандомизированном исследовании, проведенном в Германии, лечение получали 172 больных плоскоклеточным раком пищевода T3-4N0-1M0, которым на первом этапе провели 3 курса химиотерапии комбинацией FLEP (лейковорин 300 мг/м², 5-фторурацил 500 мг/м², этопозид 100 мг/м² и цисплатин 30 мг/м² 1-3- дни каждые 3 недели), а затем в группе оперативного лечения проводили химиолучевую терапию комбинацией PE (цисплатин и этопозид) на фоне лучевой терапии РОД 2 Гр до СОД 40 Гр, через 3 недели после окончания облучения выполняли операцию [7]. В группе химиолучевой терапии химиотерапия комбинацией PE проводилась на фоне лучевой терапии, суммарная доза которой составила 65 ГР. В группе оперативного лечения операции подверглись 62 больных. Основная причина невыполнения хирургического вмешательства были отказ в связи с выраженным эффектом химиотерапии или прогрессирование процесса. Из 62 оперативных вмешательств радикальная резекция была выполнена у 51 (82%) больного, у 17 (33%) была обнаружена полная резорбция опухоли. Послеоперационная летальность составила 11%. Медиана продолжительности жизни в группе оперативного лечения и химиотерапии существенно не отличались и составили 16,4 мес. и 14,9 мес., 2-летняя выживаемость - 40% и 35% соответственно. В группе оперативного лечения отмечено достоверное уменьшение частоты рецидива, что, однако, не сказалось на увеличении продолжительности жизни. Формально авторы могли заключить, что у больных операбельным раком пищевода выполнение операции не улучшает результаты химиолучевой терапии.
Однако это не совсем так. При проведении многофакторного анализа только ответ на индукционную химиотерапию (в данном случае 3 курса FLEP) оказался фактором, предсказывающим прогноз. У больных с объективным эффектом 2-летняя выживаемость составила более 50% независимо от того, какое лечение они получали впоследствии. И наоборот, больные с отсутствием эффекта от химиотерапии выигрывали от выполнения операции, которая была радикальной у 32% пациентов; 2-летняя выживаемость составила 18% и 9% в группе химиолучевой терапии.
Вопрос об отказе от операции у больных с эффектом на фоне химиолучевого лечения стал предметом исследования FFCD 9102 [8]. В исследование были включены 455 больных с резектабельной опухолью T3-4N0-1M0, которые получили 2 цикла 5-фторурацила + цисплатин (Д1-5, 22-26) и лучевую терапию (46 Гр за 4,5 недели). Если в результате был достигнут полный или частичный регресс опухоли и не было противопоказаний для хирургического лечения, больных рандомизировали на 2 группы: 1-ая группа - операция; 2-я группа -3 цикла химиотерапии 5-фторурацил + цисплатин + лучевая терапия (дополнительно 20 Гр). После проведения первого этапа лечения у 259 из 455 больных (56,9%) констатирован лечебный эффект (полный или частичный регресс), и они были рандомизированы для последующего лечения. Медиана продолжительности жизни (1-я группа - 17,7 мес.; 2-я группа - 19,3 мес.) и 2-летняя выживаемость (34% и 40% соответственно) в обеих группах существенно не различались. Авторы делают вывод о том, что у больных с эффектом (полный или частичный клинический эффект) на фоне проведения химиолучевой терапии можно отказаться от выполнения операции и продолжить химиолучевое лечение.
Исходя из результатов этих двух важнейших исследований можно, предложить следующий алгоритм лечения больных операбельным раком пищевода.
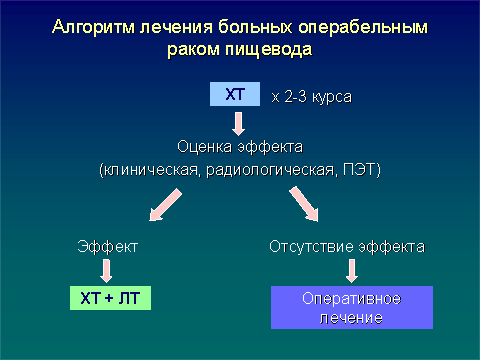
На первом этапе всем больным проводится 2-3 курса химиотерапии с включением препаратов платины с последующей оценкой клинического эффекта. Регистрация частичного или полного эффекта у больного является свидетельством чувствительности опухоли к противоопухолевым препаратам. В этом случае можно отказаться от операции и следующим этапом провести химиолучевое лечение. Больным с минимальным клиническим эффектом или отсутствием его показана попытка оперативного лечения, ибо только она дает шанс достигнуть элиминации опухоли, резистентной к химиотерапии.
Данная тактика лечения требует дальнейшего совершенствования, поскольку результаты лечения остаются крайне неудовлетворительными. Это может быть сделано за счет внедрения новых более эффективных противоопухолевых препаратов и совершенствования методики и техники проведения лучевой терапии. Не менее важным представляется определение факторов (клинических, генетических и др.), которые бы помогли выделить тех больных, которые в наибольшей степени выигрывают от выполнения оперативного вмешательства.
Список литературы:
1. Enzinger P.C., Mayer R.J. Esophageal Cancer. N. Engl. J. Med. 2003; 349:2241-52.
2. van Meerten E., van der Gaast A. Systemic treatment for oesophageal cancer. Europ. J. Cancer 2005; 41: 664–672.
3. Kelsen D.P., Ginsberg R., Pajak T.F. et al. Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer. N. Engl. J. Med. 1998; 339:1979-198.
4. Medical Research Council Oesophageal Cancer Working Group. Surgical resection with or without postoperative chemotherapy in esophageal cancer: a randomized controlled trial. Lancet 2002; 359:1727-33.
5. Malthaner R., Fenlon D. Preoperative chemotherapy for respectable thoracic esophageal cancer (Cochrane Review). In The Cochrane Library, Issue 3, 2004. Oxford: Update Software.
6. Urschel J.D., Vasan H. A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer. Am. J. Surg. 2003; 185: 538–543.
7. Stahl M., Stuschke M., Lehmann N. et al. Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J. Clin. Oncol. 2005; 23:2310-2317.
8. Bedenne L., Michel P., Bouche J.-P. et al. Randomized phase III trial in locally advanced esophageal cancer: radiochemotherapy followed by surgery versus radiochemotherapy alone (FFCD 9102). Proc ASCO 2002; 21:130a.