В.П. Летягин
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Опухоли молочных желез у мужчин встречаются значительно реже, чем у женщин. Их, как и у женщин, можно разделить на доброкачественные и злокачественные. Среди доброкачественных опухолей наиболее частой является гинекомастия (от греческого gyne – женщина и mastos – грудь). Клинически удобнее всего различать 2 формы: диффузную и узловую.
Интерес онкологов к гинекомастиям связан с фоновостью данного процесса для последующего возникновения и развития рака молочной железы: частота развития рака молочной железы у данной группы в 3-5 раз выше, чем в общей популяции.
Классическое определение гинекомастии (ВОЗ): дисгормональный гиперпластический процесс, характеризующийся широким спектром пролиферативных и регрессивных изменений ткани молочной железы с ненормальным соотношением эпителиального и соединительно-тканного компонентов.
К этиологическим моментам возникновения гинекомастий относят: состояние затяжного стресса (неудовлетворенность семейным положением, бытовые конфликты, конфликтные ситуации на работе, неблагоприятные сексуальные факторы), состояние эндокринной системы (гиперэстрогения, что часто связано с хронической печеночной недостаточностью вследствие алкоголизма).
Основываясь на этиологических факторах, выделяют 5 форм гинекомастии:
Авторитетные морфологи считают, что патологические изменения при фиброзно-кистозной болезни (дисплазии молочной железы) развиваются в пределах протоково-дольковой единицы. Участки фиброзной ткани сочетаются с кистозными полостями, кисты выстланы или атрофическим эпителием или эпителием, подвергшимся апокриновой метаплазии (иногда метаплазия носит слизистый характер). Выделяют пролиферативную и непролиферативную форму дисплазии. Считается, что степень риска развития рака молочной железы нарастает в зависимости от выраженности протоковой, дольковой или внутрикистозной пролиферации. По степени пролиферативной активности эпителия выделяют:
Частота развития рака на фоне пролиферативных форм гинекомастии зависит от длительности заболевания и периода наблюдения за больным. Причем риск перехода узловой формы в рак колеблется от 9,3 до 12,2%.
Клинически диффузная гинекомастия проявляется болезненным набуханием одной или обеих молочных желез, в ряде случаев с выделениями из сосков различного характера, грубой дольчатостью, тяжистостью, множественными уплотнениями, носящими непостоянный характер. При узловой гинекомастии участки уплотнения, чаще в одной молочной железе, носят постоянный характер и имеют тенденцию к увеличению.
Основными диагностическими методами, помимо клинического, являются маммография, УЗИ и пункционная биопсия образования (с последующим цитологическим исследованием полученного материала).
Лечение диффузной формы гинекомастии всегда консервативное. Комплекс лечебных мероприятий зависит от выраженности клинической симптоматики и данных рентгенологического исследования, а также данных обследования гормонального статуса больного.
При отсутствии гормональных нарушений целесообразно назначение фитотерапии или гомеопатических средств. Травяные сборы (фитотерапия) подбираются по принципам воздействия на основные звенья патогенеза клинической симптоматики. Травяные составляющие должны обладать следующими эффектами:
Узловые формы гинекомастии следует лечить хирургическим методом. В отличие от узловой мастопатии у женщин, при которой стандартным оперативным вмешательством является секторальная резекция со срочным гистологическим исследованием, у мужчин выполняется подкожная мастэктомия с сохранением соска и срочным гистологическим исследованием.
Нами пролечены и прослежены в отдаленные сроки 156 пациентов с гинекомастией, среди которых у 80 диагностирована диффузная форма, и они получали различные виды консервативного лечения, у 76 - узловая форма, этим больным произведена подкожная мастэктомия. Во всех случаях диагноз был подтвержден данными цитологического и гистологического исследования. Среди 76 больных с узловой формой гинекомастии рак молочной железы после срочного гистологического исследования был обнаружен у 6 пациентов, что составило 7,9%.
Рак молочной железы у мужчин встречается в среднем в 100 раз реже, чем у женщин. Данные литературы, касающиеся различных аспектов диагностики и лечения рака молочной железы у мужчин немногочисленны. Современные тенденции лечения рака молочной железы у мужчин заключаются, во-первых, в точном установлении истинной стадии заболевания, во-вторых, в усовершенствовании методов комбинированного и комплексного лечения, включающих в себя помимо хирургического лечения лучевую терапию, химиотерапию, гормонотерапию в зависимости от стадии заболевания. Наиболее часто данное заболевание встречается в 6-7 декадах жизни, хотя может встречаться в возрасте от 9 до 90 и более лет. Средний возраст составляет 60-65 лет [16,17,18,].
Наиболее частым симптомом является наличие опухоли в молочной железе. Благодаря относительно небольшим размерам, небольшой массе и объему паренхимы молочной железы у мужчин и близости ее к кожному покрову появление опухолевого узла можно определить уже на ранних стадиях развития злокачественного новообразования [21, 22, 23]. Тем не менее, только 1/3 мужчин, больных раком молочной железы, обращается к врачу в течение первого месяца после выявления признаков заболевания. Остальные больные, обнаружившие у себя изменения в молочной железе, многие месяцы, а иногда и годы не обращаются за медицинской помощью. В последнее время по данным ряда авторов эти сроки существенно уменьшились (в среднем - с 14-21 месяца до 1-8 месяцев). Однако запущенность рака молочной железы у мужчин связанна не только с недостаточно внимательным отношением к себе со стороны пациентов, но с отсутствием необходимой онкологической настороженности у врачей общего профиля. Приблизительно в 20% наблюдений диагноз рака молочной железы у мужчин при первичном обращении не устанавливается. От 6% до 30% заболевших связывают возникновение заболевания с ранее перенесенной травмой молочной железы. Семейный анамнез (наличие злокачественной опухоли молочной железы у прямых родственников первого и второго поколения) прослеживается в 7–27%случаев [35, 37].
Примерно у 5% пациентов сообщается о билатеральном раке молочной железы - синхронном или метахронном.
Чаще всего опухоль локализуется в центральных отделах молочной железы, а именно в субареолярной зоне. Поэтому примерно у половины больных на момент обращения обнаруживается симптом втяжения соска. Выделения из соска встречаются относительно редко и носят характер от серозных до кровянистых.
Фиксация кожи над опухолью наблюдается примерно у трети больных (симптомы «умбиликации», «площадки», «лимонной корочки» и т.п.). У такого же количества больных на момент выявления рака молочной железы определяется изъязвление кожи над опухолью.
Относительно нечасто (примерно у каждого седьмого пациента) наблюдается фиксация опухоли к большой грудной мышце. Болезненные ощущения в молочной железе довольно непостоянный симптом рака молочной железы у мужчин, однако, в большинстве случаев, именно он заставляет большинство пациентов обратиться за медицинской помощью. Примерно в каждом втором наблюдении при первичном обращении пациентов выявляются увеличенные аксиллярные лимфоузлы [2, 5, 7]. Однако, достоверность клинической оценки состояния подмышечной области невысока: ошибочно-положительные результаты колеблются от 8 до 50%.
Некоторые заболевания мужской молочной железы могут иметь клинические проявления, сходные с таковыми при раке, из-за чего возникает необходимость дифференциальной диагностики. Прежде всего, это относится к гинекомастии, которая выявляется примерно у трети всех здоровых взрослых мужчин, частота ее возрастает с возрастом и обнаруживается у 12-40% больных раком молочной железы. Далее по частоте возникновения идут воспалительные заболевания молочных желез (субареолярный абсцесс, эктазия протоков), не связанные с паренхимой молочной железы злокачественные новообразования мягких тканей передней стенки грудной клетки (саркомы), а также метастатическое поражение молочной железы [18, 19, 20].
Дополнительные исследования мужских молочных желез при наличии новообразования включают маммографическое исследование, ультразвуковое исследование и пункционную биопсию опухоли с цитологическим и/или гистологическим исследованием биоптата, полученного путем тонко-игольной пункционной биопсии опухоли.
Основные маммографические характеристики рака молочной железы у мужчин включают в себя хорошо определяемую массу повышенной интенсивности с нечеткими краями, содержащую в большом количестве случаев микрокальцинаты [1, 8, 9, 10]. Эти признаки легко дифференцируются с рентгенологическими проявлениями гинекомастии, при которой определяется треугольная или округлая масса молочной железы, имеющая повышенную плотность и располагающаяся симметрично в ретроареолярной области [18, 35]. Тем не менее, когда речь идет о раке молочной железы, развивающемся на фоне гинекомастии, возможны диагностические ошибки. Они обусловлены в основном тем, что возможны трудности при определении опухолевой массы на фоне повышенной плотности паренхимы молочной железы [8, 18]. В среднем ценность маммографии для диагностики рака молочной железы у мужчин составляет 80-90% [10]. При ультразвуковом исследовании определяется узлообразование с нечеткими контурами, которое также надо дифференцировать с гинекомастией.
Использованию пункционной биопсии опухоли мужской молочной железы в последнее время придается большое значение [27, 28, 29]. Материал, полученный путем пункционной биопсии опухоли, может быть подвергнут как цитологическому, так и гистологическому исследованиям. Цитологические особенности рака молочной железы у мужчин ничем не отличаются от таковых у женщин. Эффективность пункционной биопсии колеблется от 50 до 90%. Пункционная биопсия, несомненно, представляет большую диагностическую ценность для определения рака молочной железы, гинекомастии, метастатического поражения молочной железы, а также определения рецепторного статуса опухоли [16, 17, 18]. В некоторых случаях возможна цитологическая верификация рака молочной железы у мужчин при исследовании патологических выделений из соска.
Рецепторы гормонов в опухолях молочных желез у мужчин были обнаружены практически одновременно с таковыми у женщин. После того, как был доказан факт непосредственного влияния уровня рецепторов эстрогенов и прогестерона в опухоли на выживаемость больных раком молочной железы у женщин, началось активное изучение этой взаимосвязи у мужчин. Практически во всех исследованиях указывается на то, что в злокачественных опухолях мужской молочной железы уровень рецепторов эстрогенов в среднем выше, чем у женщин. Клинически значимые уровни рецепторов эстрогенов содержатся более чем в 85% опухолей молочных желез у мужчин.
Наличие рецепторположительных опухолей у мужчин не увеличивается с возрастом, как это прослеживается у женщин, больных раком молочной железы. Частота обнаружения рецепторположительных опухолей у мужчин любой возрастной группы приблизительно равна таковой у женщин в постменопаузальном периоде. Существует корреляционная зависимость между наличием клинически значимых уровней рецепторов эстрогенов и ответом на гормональную терапию [3, 4, 5, 6].
Наиболее показательный фактор прогноза - состояние регионарных лимфатических узлов. В одном из исследований, в котором изучалась 5-летняя выживаемость мужчин, больных раком молочной железы (87 человек), показано, что 77% пациентов с pN0 пережили 5-летний рубеж в противоположность группе больных с pNI-2, у которых этот показатель составил 37,5% [38]. В другом случае из 68 проанализированных случаев рака молочной железы у мужчин 10 летняя выживаемость в группе пациентов с N0 составила 55%, в группе c NI и N2 - 22% [39].
На прогноз заболевания влияет также количество пораженных метастазами лимфатических узлов. В подтверждение этого можно привести результаты метаанализа 335 случаев рака мужской молочной железы, о которых сообщалось в различных литературных источниках. Больные были разделены на 3 группы - без признаков метастатического поражения аксиллярных лимфоузлов, с поражением от 1 до 3 лимфатических узлов, и с поражением 4 и более лимфоузлов. 5-летняя выживаемость составила соответственно 90%, 73% и 55% в каждой из групп [27].
На прогноз рака молочной железы у мужчин влияет и гистологическая разновидность опухоли [33]. Некоторые гистологические типы инвазивных карцином ассоциируются с относительно благоприятным прогнозом. Это, прежде всего, так называемые особые гистологические варианты рака молочной железы - медуллярная, папиллярная и слизистая карциномы.
Что касается степени злокачественности опухоли, то здесь также прослеживается прямая связь с прогнозом заболевания. Чем выше степень злокачественности опухоли, тем короче период выживания больных.
Больные с опухолью I степени злокачественности выживают 5 лет и более после операции в 75% наблюдений, более 10 лет - в 45%; для больных с опухолями II и III степени злокачественности эти цифры составляют соответственно 53% и 27%; 31 и 18% наблюдений. Кроме степени злокачественности, прогностическое значение имеют следующие факторы: наличие псевдокапсулы, лимфоплазмоклеточная инфильтрация, инвазия экстрамаммарных тканей и лимфатических и кровеносных сосудов, а также наличие метастазов, значение последних перекрывает все остальные. Указанные факторы должны быть отражены в диагнозе [27].
На сегодняшний день ведется активный поиск факторов, которые позволяли бы прогнозировать течение рака молочной железы у мужчин. Однако пока наиболее значимым фактором прогноза является стадия ракового процесса: размер первичной опухоли и статус регионарных лимфатических узлов [1, 2, 7, 8, 11].
К сожалению, на сегодняшний момент нет единого взгляда на проблему терапии рака мужской молочной железы. Принципы лечения рака молочной железы у мужчин до сих пор базируются на знаниях, полученных в ходе лечения женщин с аналогичной патологией [21]. Причины такого положения дел уже назывались: редкая встречаемость этой нозологической формы у мужчин, изменения в подходах диагностики и лечения, происходящие в процессе длительного набора анализируемых больных, большой отрезок времени, необходимый для набора достаточного для анализа количества пациентов, что, в конечном итоге, затрудняет проспективное изучение этого заболевания.
При начальных стадиях заболевания на первом этапе лечения основным методом является хирургический. В основном применяются различные варианты мастэктомий (радикальная мастэктомия по Холстеду-Майеру, по Пейти, радикальная мастэктомия с сохранением обеих грудных мышц, простая мастэктомия) [19, 24, 29, 40].
Единого мнения относительно значения лучевого метода лечения в послеоперационном периоде у больных раком молочной железы нет до сих пор. Влияние послеоперационного облучения на выживаемость больных рядом исследователей подвергается сомнению. Одни авторы утверждают, что лучевая терапия, проводимая больным раком молочной железы мужчинам, не приводит к улучшению выживаемости и не влияет на частоту возникновения местных рецидивов заболевания [19, 20, 21]. Другие статистически обоснованно утверждают обратное [12, 38]. Согласие царит лишь в утверждении, что с помощью одной только лучевой терапии в послеоперационном периоде невозможно достичь лечебного эффекта.
Наибольшее потенциальное значение лучевая терапия приобретает у больных, у которых существует высокий риск возникновения локально-регионального рецидива заболевания.
Основная задача лучевой терапии при раке молочной железы у мужчин - снижение числа местных рецидивов опухоли и уменьшение частоты метастазов в регионарных зонах. Она показана при больших размерах первичной опухоли, медиальной и центральной локализации ее, мультицентричности роста, большом количестве пораженных лимфоузлов, удаленных в ходе операции, и при нерадикальном характере оперативного вмешательства.
Химиотерапия и гормонотерапия рака молочной железы у мужчин всецело базируются на наиболее оправдавших себя в отношении эффективности принципах лечения рака молочной железы у женщин. В последнее время проводится целый ряд исследований по использованию таксанов в качестве адъювантного лечения. На данный момент нет контролируемых клинических испытаний эффективности того или иного режима химиогормонотерапии этого злокачественного новообразования, хотя, по сведениям некоторых авторов, в недалеком будущем ожидается публикация таких результатов [36].
Примерно до начала 70-х годов прошлого столетия многим больным наряду с хирургическим и лучевым методами лечения выполнялась орхэктомия. Однако, как показали дальнейшие исследования, это не приводило к увеличению выживаемости больных раком молочной железы [1, 26].
С началом эры тамоксифена этот препарат был апробирован при мужском раке молочной железы. Как показали исследования, прием мужчинами, у которых имеется рак молочной железы, антиэстрогенов вполне себя оправдал [19, 20, 21]. Однако нужно отметить, что прием тамоксифена мужчинами сопряжен с гораздо более высоким риском развития побочных эффектов, чем у женщин [4, 13, 23]. По убыванию частоты встречаемости побочных эффектов вследствие приема тамоксифена они располагаются следующим образом: снижение либидо, прибавка в весе, кожная сыпь, ощущение горячих «приливов», депрессия, бессонница, алопеция, флебиты, тромбоз глубоких вен. В некоторых работах сообщается о смертельных исходах вследствие приема мужчинами тамоксифена. В основном, причинами их являлись острые тромбоэмболии крупных венозных стволов [4, 25, 30].
Хочется отметить, что, несмотря на осложнения, к которым может привести лечение антиэстрогенами рака молочной железы у мужчин, ни одним из авторов не отвергается сама идея их использования. Польза от приема этих препаратов значительно перевешивает тот ущерб, который может оказать побочное действие. Поэтому у пациентов с рецепторположительными опухолями антиэстрогены должны быть включены в обязательном порядке в схему адъювантного лечения рака молочной железы.
Существует не так уж много исследований, в которых рассматривается вопрос химиотерапии рака молочной железы у мужчин. Что касается начальных стадий этого заболевания, то в плане адъювантного лечения используется полихимиотерапия, включающая циклофосфан, метотрексат и 5-фторурацил (CMF), или же циклофосфан, доксорубицин, 5-фторурацил (FАС). В Национальном Институте Рака (США) были проведены исследования эффективности химиотерапии у больных раком молочной железы II стадии, перенесших радикальное хирургическое лечение [10]. 5-летняя выживаемость во всей группе составила 80%, что существенно лучше, чем в других группах.
В другом сообщении, где проводилась адъювантная химиотерапия по поводу рака молочной железы II или операбельной III стадии заболевания по схеме FAC, 5-летнее выживание в группе составило 85% [14].
Таким образом, мужчинам, болеющим раком молочной железы начальных стадий, в плане адъювантного лечения целесообразно проводить химиогормонотерапию. При этом должны учитываться следующие факторы: статус подмышечных лимфоузлов (есть или нет метастатическое поражение их), риск возникновения локально-регионального рецидива, а также рецепторный статус опухоли. Некоторые исследователи рекомендуют проведение адъювантной химиотерапии в сочетании с тамоксифеном у больных с РЭ-положительными и только химиотерапию - при РЭ-отрицательных опухолях.
К сожалению, до 20% мужчин, болеющих раком молочной железы, на момент первого обращения за медицинской помощью имеют отдаленные метастазы [15, 32]. В то же время, у 18-54% пациентов отдаленные метастазы развиваются после лечения локализованных форм заболевания [19]. Наиболее часто метастазы опухоли выявляются в костях, легких, печени, головном мозге [19, 20]. Как видим, кроме того, что эти данные подтверждают необходимость проведения эффективного комплексного системного лечения ранних стадий рака молочной железы у мужчин, они заставляют разрабатывать методы не менее эффективной терапии поздних стадий заболевания. На сегодняшний день лечение местно-распространенных и генерализованных форм рака молочной железы у мужчин включает применение комплекса мероприятий в виде гормоно- и химиотерапии, лучевой терапии и в некоторых случаях - паллиативного хирургического лечения.
Исторически сложилось таким образом, что в плане терапии поздних стадий рака молочной железы у мужчин впервые была применена гормонотерапия в виде орхэктомии. В ранних работах, посвященных эффективности этого вида гормонотерапии, указывается на повышение продолжительности жизни больных с IV стадией заболевания, подвергшихся этому виду операции. Так, в объединенном обзоре результатов лечения с применением орхэктомии, среднее время продолжительности жизни мужчин с IV стадией рака молочной железы составило 56 мес. в группе подвергшихся этой операции против 38 мес. в группе больных, где этот вид лечения не выполнялся [34].
Другие эндокринные оперативные вмешательства, такие как адреналэктомия и гипофизэктомия, представляют собой эффективные паллиативные виды лечения поздних стадий рака молочной железы у мужчин. Степень чувствительности при выполнении их составляет 76% и 58% соответственно [20, 38].
Однако, несмотря на эффективность гормонотерапии, этот вид лечения не является первоочередным методом паллиативной терапии рака молочной железы у мужчин. Такое положение вещей сложилось в силу многих причин, важнейшими из которых являются неприятие многими мужчинами орхэктомии, высокая частота осложнений, включая и смертельные после выполнения адреналэктомии и гипофизэктомии. Немаловажное значение в противовес гормонотерапии приобрела также альтернативная химиогормонотерапия, позволяющая обойтись без хирургических вмешательств [20, 38].
В качестве гормонотерапии первой линии при паллиативном лечении рака молочной железы у мужчин большинство авторов применяют тамоксифен [12, 19, 20]. Эффективность его составляет от 25 до 58% при средней продолжительности приема препарата от 7 до 21 мес., при этом переносимость этого антиэстрогена относительно удовлетворительная. Чувствительность к тамоксифену в частности и к гормональной терапии вообще у больных поздними стадиями рака молочной железы мужчин напрямую зависит от статуса рецепторов гормонов. Ответ на гормонотерапию коррелирует с уровнем рецепторов гормонов в опухоли. У пациентов с отрицательными рецепторами гормонов, как правило, ответ на гормонотерапию значительно хуже [9, 12, 15]. Использование аналогов гонадотропин-рилизинг-гормонов и антиандрогенов сопряжено с возможностью появления различных побочных эффектов - горячих приливов, снижения либидо, импотенции, гинекомастии, однако возникают они довольно редко [20, 38].
Другие гормональные агенты, обуславливающие временную регрессию отдаленных метастазов рака молочной железы у мужчин, включают эстрогены, прогестины, андрогены, кортикостероиды и ингибиторы ароматазы.
Следует отметить, что ввиду отсутствия достаточных для анализа данных, оптимальные режимы полихимиотерапии для лечения метастатического рака мужской молочной железы пока не определены [15, 17, 19, 31].
За период с 1957 по 2000 г. в клиниках ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России находились на лечении 188 мужчин, страдающих раком молочной железы различных стадий. Средний возраст пациентов составил 57,4 лет.
В табл. 1 представлено распределение больных в зависимости от степени распространенности процесса.
Таблица 1.
Распределение больных в зависимости от степени распространенности опухолевого процесса.
| Стадии | Количество больных | % |
|---|---|---|
| I–IIA | 34 | 18,0 |
| IIБ | 30 | 15,9 |
| III | 88 | 46,8 |
| IV | 24 | 12,7 |
| Всего | 188 | 100 |
Обращает на себя внимание тот факт, что большинство (46,8%) больных при первичном обращении имели значительное местное распространение опухолевого процесса.
При анализе первичных проявлений рака молочной железы у мужчин отмечено, что наиболее частыми симптомами были наличие узлового образования в молочной железе, деформация сосково-ареолярной области, изменения кожи над опухолью, изъязвление кожи, отечность железы.
Распределение больных в зависимости от методов лечения представлено в табл. 2.
Таблица 2.
Виды лечения у 188 мужчин, больных раком молочной железы.
| Вид лечения | Количество больных | % |
|---|---|---|
| Хирургическое | 25 | 13,3 |
| Комбинированное | 62 | 33,0 |
| Комплексное | 77 | 41,0 |
| Консервативное | 24 | 12,7 |
| Всего | 188 | 100 |
Наиболее частым методом оперативного вмешательства была радикальная мастэктомия с сохранением одной или обеих грудных мышц (57,6%). Все остальные виды операций использовались приблизительно в 2 раза реже (табл. 3).
Таблица 3.
Виды оперативных вмешательств у 163 оперированных мужчин, больных раком молочной железы.
| Тип операции | Количество больных | % |
|---|---|---|
| РМЭ (Холстед) | 47 | 28,5 |
| РМЭ (с сохранением одной или обеих грудных мышц) | 95 | 57,6 |
| РМЭ (Мадден) | 23 | 13,9 |
| Всего | 165 | 100 |
В связи с тем, что у основной массы пациентов при первичном обращении было выявлено значительное местное распространение процесса, в 74,0% случаев использовался комбинированный и комплексный методы лечения. Предоперационная терапия была проведена 34 больным (табл. 4).
Таблица 4.
Виды предоперационного лечения.
| Вид терапии | Число больных | % |
|---|---|---|
| ЛТ* крупными фракциями | 15 | 44,1 |
| ЛТ 40 Гр | 1 | 2,9 |
| ЛТ – ХТ | 9 | 26,5 |
| ЛТ + ГТ | 1 | 2,9 |
| ГТ | 1 | 2,9 |
| ЛТ + ХТ + ГТ | 3 | 8,8 |
| ХТ + ГТ | 2 | 5,9 |
| ХТ | 2 | 5,9 |
| Всего | 34 | 100 |
В связи с большими размерами опухолевого узла при отсутствии кожных проявлений основным методом неоадъювантного лечения была лучевая терапия по методике укрупненного фракционирования дозы (44,1%). При III стадии процесса лучевая терапия по методике обычного фракционирования дозы (СОД=40 Гр, РОД=2 Гр) чаще сочеталась с неоадъювантной химиотерапией. В 4 случаях в качестве неоадъювантного лечения использовалась только химиотерапия препаратами антрациклинового ряда, причем в 2 случаях при рецепторположительной опухоли в сочетании с гормонотерапией.
Адъювантное лечение было проведено 104 больным (табл. 5). Наиболее часто в качестве адъювантного лечения использовалась химиотерапия (92 больных), причем в 51 случае при рецепторположительных опухолях она сочеталась с гормонотерапией. При внутренней или центральной локализации опухолевого узла в послеоперационном периоде лечение дополнялось лучевой терапией на парастернальную зону (18,3%).
Таблица 5.
Виды адъювантного лечения.
| Вид лечения | Количество больных | % |
|---|---|---|
| ЛТ* | 1 | 0,96 |
| ХТ + ГТ | 33 | 31,7 |
| ЛТ + ХТ + ГТ | 18 | 17,3 |
| ХТ | 40 | 38,5 |
| ЛТ + ХТ | 1 | 0,96 |
| ГТ | 11 | 10,6 |
| Всего | 104 | 100 |
Схемы химиотерапии, применявшиеся при раке молочной железы у мужчин, представлены в табл. 6. В последние годы наиболее часто используются антрациклинсодержащие схемы полихимиотерапии.
Таблица 6.
Химиотерапия, используемая при лечении рака молочной железы у мужчин.
| Количество больных | % | |
|---|---|---|
| Тиофосфамид | 55 | 41,7 |
| CMF | 36 | 27,3 |
| CMFVP | 9 | 6,8 |
| VCAF | 11 | 8,3 |
| VAM | 9 | 6,8 |
| Другие антрациклинсодержащие схемы | 11 | 8,3 |
| 5-FU + митоксантрон | 1 | 0,75 |
| Всего | 132 | 100% |
При изучении уровня стероидных гормонов в опухоли нами отмечены более высокие показатели по сравнению с аналогичными исследованиями у женщин (табл. 7). Кроме того, не обнаружено связи высоких уровней рецепторов с возрастом больных.
У 66 (85,7%) больных уровень рецепторов эстрогенов был выше 10 фмоль/мг белка, а у 11 (14,3%) - ниже. У 43 (58,9%) пациентов уровень рецепторов прогестерона был выше 10 фмоль/мг белка, а у 30 (41,1%) - ниже.
Таблица 7.
Уровень рецепторов эстрогенов и прогестерона у мужчин.
| Вид рецепторов | Уровень стероидных гормонов (фмоль/мг белка) | |||||
|---|---|---|---|---|---|---|
| 10-50 | 50-100 | 100 и более | ||||
| n | % | n | % | n | % | |
| РЭ (n=70) | 43 | 61,4 | 16 | 22,8 | 7 | 10,0 |
| РП (n=53) | 22 | 41,5 | 19 | 35,8 | 12 | 22,6 |
Необходимо отметить особенную сложность лечения диссеминированных форм рака молочной железы у мужчин, и потому данные представляют наибольший интерес. Основными лечебными мероприятиями в таких случаях остаются химиогормонотерапия и лучевая терапия на очаги поражения (табл. 8).
Таблица 8.
Консервативная терапия у больных с IV стадией.
| Количество больных | % | |
|---|---|---|
| ХТ* | 4 | 16,7 |
| ХТ + ГТ | 10 | 41,7 |
| ЛТ + ХТ | 1 | 4,17 |
| ЛТ + ХТ + ГТ | 8 | 33,3 |
| ГТ | 1 | 4,17 |
| Всего | 24 | 100 |
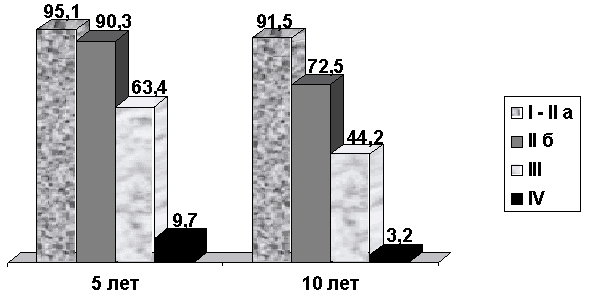
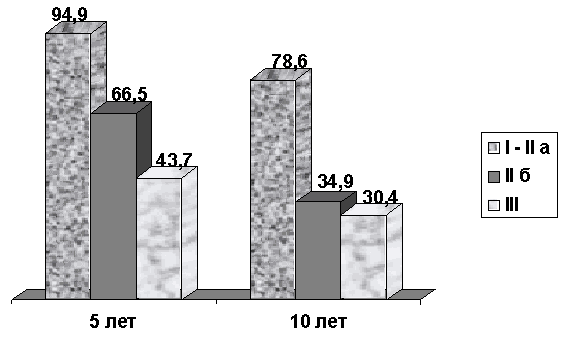
При анализе отдаленных результатов (рис. 1) обращают на себя внимание довольно высокие показатели 10-летней выживаемости у больных c I–IIА стадией рака молочной железы, составившие 91,5%, а также высокая 5- и 10-летняя выживаемость больных c IIБ стадией заболевания, составившая 90,3% и 72,5%. Показатели выживаемости при IV стадии заболевания составили 9,7% и 3,2% соответственно. Показатели безрецидивной выживаемости иллюстрирует рис. 2.
Таким образом, при изучении особенностей течения рака молочной железы у мужчин нами установлено:
Список литературы:
1. Готько Е.С. // Эксперим. Онкол. –2000. - 22, Suppl.- c. 238.
2. Летягин В.П. // Москва, 2000. - 395 с.
3. Летягин В.П., Лактионов К.П., Высоцкая И.В., Погодина Е.М. и др. М., 1996. – 150 стр.
4. Тадуа Р. // Эксперим. Онкол. – 2000. -22, Suppl. – с. 265.
5. Caglija P., Verour P.F., Cardillo P., Nicosia A. // G. Chir. –1998. – 19, №8-9. - с. 358-362
6. Chiappo L., Bergantino A., Colla M. et al. // Minerva chir.-1998. - 53, № 9. - с. 767-768
7. Сhvallier A.,Boissy C., Rampal A. et al. // Arch anat.et. cytolog. Pathol. – 1999. - 47, № 2. - c. 88-91.
8. Gadrobbi R, Guerini A., Battaglino D. et al. // Acta chir. Ital. – 2000. – 56, № 2. - c. 131-138.
9. Gupta Raj K. // Diagn. Cytopathology. - 1999. - 21, № 3. – с. 167-169.
10. Herman K., Lobazievouz W., Skotnicki P., Fortuna J. // Neoplazma – 2000. - 47, № 3. - c. 191-195.
11. Janckovic S., Petricevic A., Bilic J., Andelicovic S. // Eur. Radiol.-1999. - 9, прил № 1. – с. S413.
12. Kuwashima Yoshio, Kishi Kiyozo, Suemasu Kimito // Selec.Pap. Suitama cancer Cent. – 1996. – 18 – c. 344-347.
13. Osteen RT, Kamell LH. // Cancer 73:1994. - 2000, 1994
14. Rabanal E., Rosell R., Salvies J., Garcia R. // Eur. Radiology - 1999. – 9, прил. № 1. – с. S414.
15. Ribeiro G, Swindell R. // Br J Cancer 65:252-254, 1992.
16. Salerni B. // deta chir. Ital. - 2000. – 56, № 2 – с. 125-129.
17. Salvadori B, Saccozzi R, Manzari A, et al. // Eur J Cancer 30A:930 - 935, 1994
18. Sciacca P., Benni B., Marinelli C., Borrello M., Massi G. // Minerva chir. – 2000. - 55, №5. - c. 307-312.
19. Scott-Conner CE, Jochomsen PR, Menck HR, Winchester DJ. // Surgery. - 1999 Oct 126:775-80; discussion 780-1
20. Serra Dfaz C; Vizoso F; Rodriguez JC. et al. // World J Surg, 1999 May, 23:5, 439-45
21. Serra Diaz С, Vizoso F, Lamelas ML. et al. // Zhonghua Wai Ke Za Zhi 1997 0ct; 35(10):592-3.
22. Sorensen HT, Friis S, Olsen JH. et al. // Am J Gastroenterol. - 1998 Feb 93:231-3.
23. Speriongano P, Pisaniello D. // Ann Hal Chir - 2000 Mar-Apr; 71(2):165-6.
24. Srensen HT; Friis S; Olsen JH. et al. // Am J Gastroenterol. - 1998 Feb; 93(2): 231-3.
25. Stewart R.A.L., Howlett D.C., Hearn F.J. // Clin. Radiol. – 1997. –52, № 10. – c. 739-744.
26. Suizok Z, Kves 1. // Eur J Surg Oncol - 19(Suppl l):581-586, 1993.
27. Takeuchi T; Komatsuzaki M; Minesaki Y. et al. // J Dermatol. - 1999. - Apr, 26:4, 248-52.
28. Tan PH; Sng IT. // Pathology. - 1997 Feb, 29:1, 2-6.
29. Teixeira MR, Pandis N, Dietrich CU. et al. // Genes Chromosomes Cancer. 1998 Sep 23:16-20.
30. Titus J, Sillar RW, Fenton LE. // Aust N Z J Surg 2000 Feb;70(2): 144-6.
31. Uematsu M, Okada M, Ataka К. // Kobe J Med Sci 1998 Aug; 44(4):163-8.
32. Ulutin С, Guden M, Surenkok S, Pak Y. // Radiat Med 1998 Sep-0ct; 16(5):383-6.
33. van Geel AN, van Slooten EA, Mavrunac M, Hart AA. // Br J Surg 1985 Sep;72(9):724-7
34. Voipe CM, Raffetto JD, Collure DW, Hoover EL, Doerr RJ. // Am Surg. 1999 Mar 65:250-3.
35. Wallace WA, Balsitis M, Harrison BJ. // Eur J Surg Oncol 2001 Jun; 27(4):429-31.
36. Weiderpass E, Ye W, Adami HO, Vainio H, Trichopoulos D, Nyren O. // Cancer Causes Control 2001 Sep; 12(7):661-4.
37. Yang WT. // AJR Am J Roentgenol. OI-Feb-2001; 176(2): 413-6.
38. Yildirim E; Berberoglu U. // Eur J Surg Oncol. 1998 Dee; 24(6): 548-52.
39. Zeili GP, Martino G, Pascarella G. et al. // G Chir 1997 0ct; 18(10):761-4.
40. Zelli G.P.,Martino G.,Pascarella G.,Cariatti S. // G. Chir – 1997. - 18, № 10 – c. 761-764.