Е.А. Демина
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
С середины 70-х гг. ХХ века возможность излечения большинства больных лимфомой Ходжкина стала аксиомой. Использование современных стандартизированных программ лечения позволяет получить полные ремиссии у 85-90% больных в группе больных в целом, а 10-летняя выживаемость по данным ведущих исследовательских центров превышает 70%, достигая у больных благоприятной и промежуточной прогностических групп 90% и более [1-8]. Однако эффективность терапии больных в крупных исследовательских центрах, проводящих лечение со строгим соблюдением схем и режимов лечебных протоколов, выше, чем в общей системе онкологической службы [8]. Причин для такого различия несколько.
Во-первых, различается оценка исходного статуса больных врачами общей сети и специалистами исследовательских центров. Германская группа по изучению лимфомы Ходжкина (GHSG) провела анализ трактовки результатов обследования больных, вошедших в протоколы HD10 и HD11 (протоколы по сравнению программ BEACOPP и CVPP/ABVD), врачами на местах и специалистами Центра по документам, представленным лечащими врачами. Изменение стадии было произведено у 1,5% и 1,6% больных, а коррекция зон поражения, и, следовательно, объема лучевой терапии - у 49% и 67% больных соответственно, что привело к увеличению объема лучевой терапии у 34% больных [8].
Во-вторых, нарушение запланированного лечения чаще отмечается при выполнении его в системе общей онкологической службы. Поэтому в РОНЦ была поставлена задача оценить, как нарушение режима лечения влияет на непосредственные и отдаленные результаты лечения. Комплексная оценка по материалам РОНЦ возможна в связи с тем, что с середины 70-х гг. в РОНЦ лечение абсолютного большинства больных лимфомой Ходжкина осуществляется по протоколам. Причем каждый следующий протокол базируется на данных предыдущих исследований.
С начала 70-х гг. РОНЦ проводит лечение большинства больных лимфомой Ходжкина совместно с районными онкологами. Это вызвано тем, что современные программы лечения этого заболевания длительны – занимают от 5 до 8 месяцев, курсы химиотерапии проводятся с плановыми перерывами, переносятся вполне удовлетворительно и долгое пребывание больного в стационаре нецелесообразно. Коечный фонд и возможности дневного стационара РОНЦ позволяют проводить лечение не более 30-40 первичных больных лимфомой Ходжкина в год, однако с помощью районных онкологов возможность получить лечение по протоколам РОНЦ получает в два раза большее число больных. Лечение было оценено у 566 первичных больных с гистологически подтвержденным диагнозом лимфомы Ходжкина, получавших лечение по протоколам РОНЦ с июля 1975 г. по ноябрь 2005 г., и прослеженных после окончания лечения не менее 4 месяцев. Мужчин было 224 (39,5%), женщин 343 (60,5%), медиана возраста - 27 лет (14-61 год). Больных с I стадией было 50 (8,7%), со II - 341(59,6%), с III - 113 (19,7%), с IV - 68 (12%); симптомы интоксикации имелись у 163 (28,8%) больных и отсутствовали у 403 (71,2%). Медиана прослеженности составила 58 месяцев. Для больных с I и II стадиями с 1979 по 1985 гг. проводилась рандомизация между радикальной лучевой терапией, полихимиотерапией и комбинированным химиолучевым лечением. При комбинированном лечении проводилось облучение зон исходного поражения у больных с благоприятным (по критериям EORTC) прогнозом и облучение всех лимфатических коллекторов выше диафрагмы + облучение забрюшинных лимфатических коллекторов у больных с неблагоприятным прогнозом, всего 278 больных. С 1986 г. до1998 г. больные последней группы (72 больных) продолжали получать комбинированное химиолучевое лечение с облучением только зон исходного поражения. Больным с III и IV стадиями проводилась химиотерапия преимущественно по схеме CVPP (а также СVPP/ABV или CVPP-ABVD) с добавлением облучения на зоны остаточных лимфатических узлов (90 больных). С 1998 г. лечение выбирается в соответствии с прогностическими критериями, предложенными GHSG. Больным благоприятной прогностической группы лечение проводится 4 циклами ABVD + облучение зон исходного поражения, промежуточной – 6 циклов ABVD + облучение зон исходного поражения, неблагоприятной – по программе BEACOPP (или BEACODP) + облучение остаточных лимфатических узлов и зон исходно больших массивов. Общая и безрецидивная 10-летняя выживаемости в группе в целом (566 больных) составили 73% и 66% соответственно (рис. 1).
Лечение только в РОНЦ проведено 291 больному (51%), частично в РОНЦ, а частично по месту жительства - 248 больным (43,8%), в соответствии с рекомендациями РОНЦ полностью по месту жительства с контролем и последующим наблюдением в РОНЦ – 24 больным (5,2%). В РОНЦ проведены1733 цикла полихимиотерапии и 1234 цикла – по месту жительства. Лучевую терапию в РОНЦ получили 394 больных и 24 больных провели лучевую терапию по месту жительства.
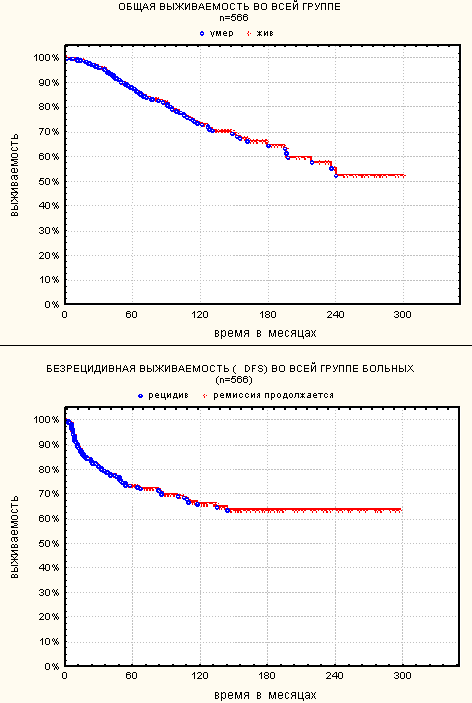
Рис. 1.
Общая и безрецидивная выживаемости в группе больных лимфомой Ходжкина, получавших лечение в РОНЦ.
Лечение без нарушения программы, то есть с соблюдением запланированных разовых и суммарных доз, интервалов в лечении, количества циклов и объема лучевой терапии проведено у 163 (28,8%) больных, у 183 (32,3%) больных было удлинение программы лечения на 4 недели, а у 220 (38,8%) больных – более 4 недель. При оценке выживаемости больных в зависимости от увеличения длительности выполнения программы, статистически значимого различия в общей (OS) и безрецидивной (DFS) выживаемости, а также в выживаемости, свободной от неудач лечения (FFTF), зависящей от заболевания и бессобытийной выживаемости (EFS), выявлено не было (р=0,3). Однако это положение справедливо только для больных, у которых увеличение длительности каждого из интервалов не превышало 4 недель. При увеличении хотя бы одного интервала на 4 и более недель выявлено статистически значимое снижение OS, DFS и DSS (рис. 2), но различия в FFTF и EFS не обнаружено (р=0,5). Это означает, что большие перерывы в лечении не снижают частоту достижения полной ремиссии, но увеличивают частоту рецидивов. Таким образом, критическим для снижения эффективности лечения является удлинение хотя бы одного интервала на 4 и более недель (когда интервал превышает 6 недель).
При анализе причин нарушения программы оказалось, что, несмотря на то, что лейкопения II-III степени была констатирована у 46% больных, она послужила причиной удлинения интервалов лишь у 18% больных; в 7,7% случаев причиной прекращения лечения или увеличения интервалов стал отказ больного, в 4,2% - инфекция, в 2,6% - прогрессирование заболевания. Самой распространенной причиной нарушения программы (44%) была социальная: отсутствие препаратов, нехватка мест в стационаре или неоправданно длительное обследование. Наиболее четко лечение осуществлялось, если вся программа проводилось в РОНЦ – нарушение отмечено лишь у 28,6% больных. Если лечение проходило преимущественно в РОНЦ и лишь часть курсов химиотерапии – по месту жительства, нарушения программы зафиксированы в 40,4% случаев, а если в РОНЦ проводилось лишь обследование, выбор программы и начало лечения, а основная часть курса проводилась по месту жительства, то нарушение программы выявлено у 63,5% больных. Это свидетельствует о том, что врачи общей сети не вполне понимают, насколько эффективность терапии зависит от строгого соблюдения всех компонентов программы лечения.
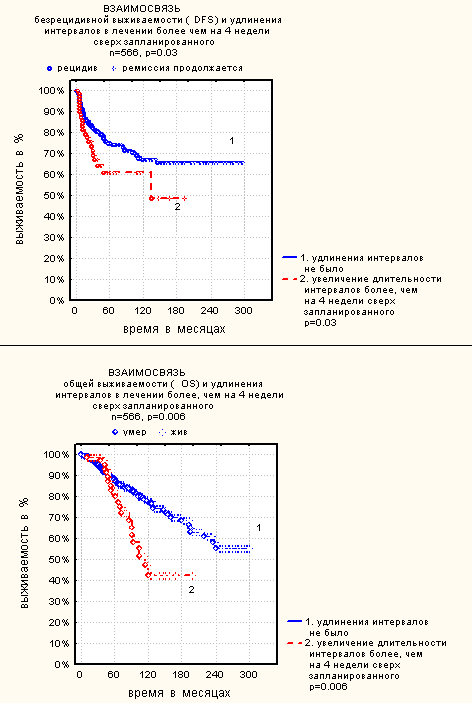
Рис. 2.
Влияние интервалов в лечении на общую и безрецидивную выживаемость.
Полихимиотерапию в самостоятельном режиме или в сочетании с лучевой терапией получили 490 больных. Полный запланированный объем химиотерапии получили 388 (79,6%) больных, у 70 (14%) больных суммарная доза химиотерапии была снижена менее чем на 30%, а у 32 (6,2%) больных доза химиопрепаратов снижена более чем на 30%. Полная ремиссия достигнута у 432 больных: у 350 (90%) больных в группе, получившей полный объем химиотерапии, у 59 (84%) больных в группе со снижением суммарной дозы менее, чем на 30% и у 23 (72%) больных в группе со снижением суммарной дозы химиопрепаратов более чем на 30%. Частота полных ремиссий в группе больных со снижением курсовой дозы химиопрепаратов более чем на 30% от запланированного была статистически значимо меньше по сравнению с остальными больными – 67,7% против 89,3% (р=0,003). В то же время частота рецидивов была больше в группе больных, получивших уменьшенную на 30% суммарную дозу химиопрепаратов – 48% (11 больных) по сравнению с 21,3% (87 больных) в группе остальных больных (р=0,003). Различий в общей выживаемости больных в зависимости от уменьшения суммарной курсовой дозы химиопрепаратов выявлено не было, однако EFS и FFTF статистически значимо различались (рис. 3).
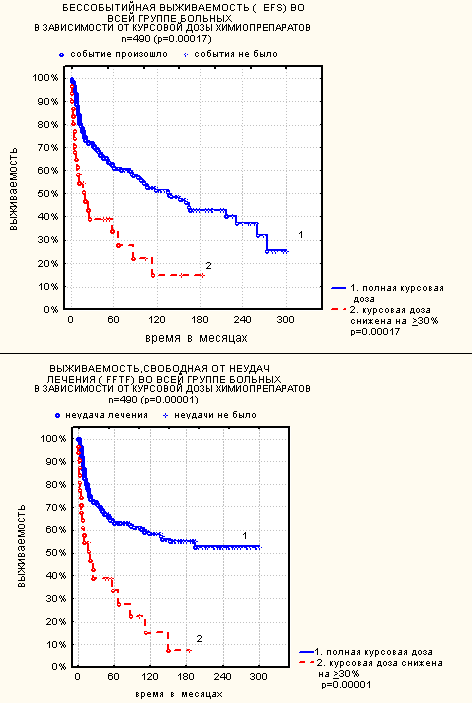
Рис. 3.
Влияние курсовой дозы химиопрепаратов на выживаемость.
Влияние редукции доз химиопрепаратов на выживаемость остается таким же и в группе больных, у которых решение вопроса о сокращении объема химиотерапии принималось после достижения полной ремиссии (рис. 4).
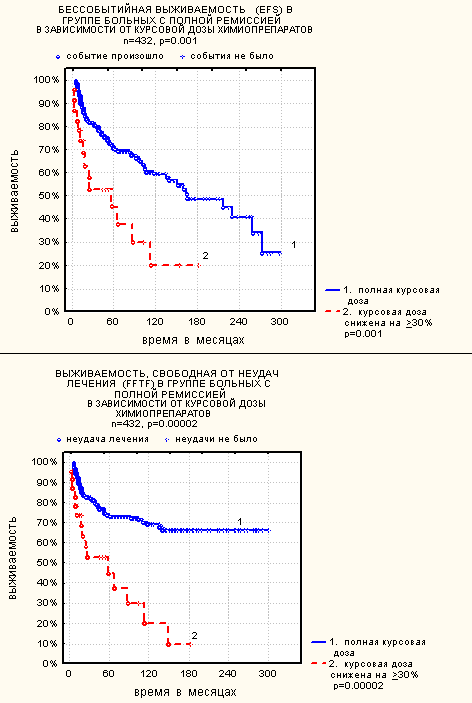
Рис. 4.
Влияние курсовой дозы химиопрепаратов на выживаемость больных, достигших полной ремиссии.
Совершенно естественно, что такое же влияние, как уменьшение курсовой дозы, на эффективность лечения имеет и редукция количества циклов полихимиотерапии. На рис.5 представлены бессобытийная и свободная от неудач лечения выживаемости в зависимости от уменьшения числа циклов на 1 или 2 у больных, достигших полной ремиссии до решения вопроса о сокращении количества циклов полихимиотерапии.
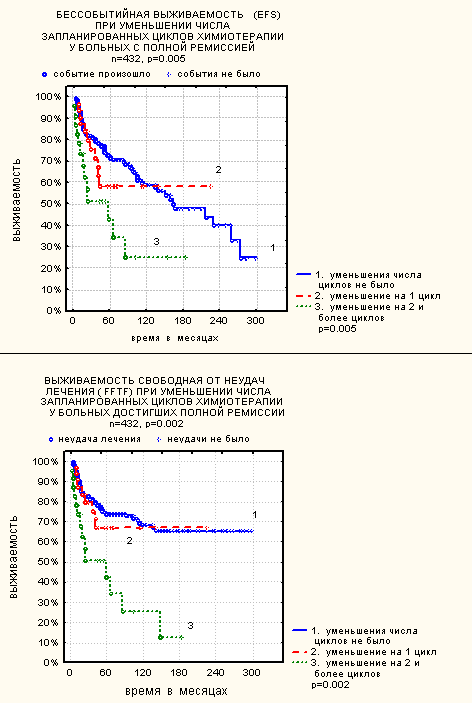
Рис. 5.
Влияние количества циклов химиотерапии на выживаемость больных, достигших полной ремиссии.
То есть, в отличие от увеличения интервалов, где ключевым является хотя бы однократное удлинение на 4 недели, для уменьшения общей курсовой дозы химиотерапии не важно, каким образом происходит это уменьшение – понемногу на каждом цикле или сразу в конце лечения. Достижение полной ремиссии перед отменой последних циклов химиотерапии не уменьшает риска рецидивов.
Комбинированная терапия была запланирована 354 больным. Полный объем лечения получили 325 больных, у 29 больных лучевая терапия не проводилась. Из этих 29 больных у 11 лучевая терапия не проводилась в связи с прогрессированием, но у 18 больных была достигнута полная ремиссия до решения вопроса об отказе от лучевой терапии. 11 больных, у которых лучевая терапия не проводилась в связи с прогрессированием, из дальнейшей оценки исключены. Полная ремиссия до лучевой терапии была достигнута у 113 больных (95 больных, которым впоследствии была проведена лучевая терапия, и 18 больных, которым лучевая терапия не проводилась). Частота рецидивов была статистически значимо выше (34% против 15%, р=0,04) в группе больных, достигших полной ремиссии в результате полихимиотерапии, которым лучевая терапия не проводилась, по сравнению с группой больных, которым лучевая терапия была проведена в соответствии с планом лечения. Как общая, так и безрецидивная выживаемость оказались статистически значимо выше в группе больных, получивших лучевую терапию в соответствии с планом лечения (рис. 6).
Таким образом, современные программы терапии лимфомы Ходжкина являются высокоэффективными, но лишь в том случае, когда строго соблюдается режим проведения лечения и дозы химиопрепаратов.
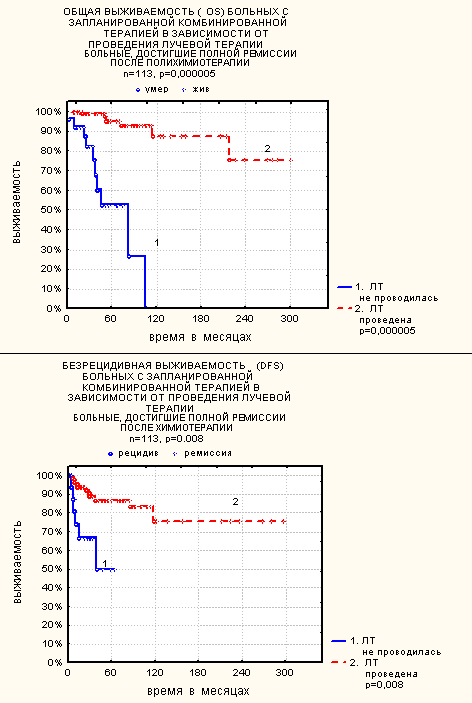
Рис. 6.
Влияние лучевой терапии на выживаемость больных, достигших полной ремиссии в результате химиотерапии.
Полученные результаты показывают, что программы последних двух поколений терапии лимфомы Ходжкина хорошо сбалансированы, и изменение их как в сторону уменьшения, так и в сторону увеличения интенсивности лечения должно иметь под собой хорошую теоретическую и диагностическую базу, а не решаться волюнтаристически.
Список литературы:
1. Hodgkin’s disease. Ed. by Mauch P.V., Armitage J.O., Diehl V. et al.-Philadelphia.–1999.
2. Cancer: Principles & Practice of Oncology.-Vol 2.-6th ed/Eds. by V.T.DeVita, S. Hellman, S.A. Rosenberg.-Philadelphia: Lippincott-Raven Publishers, 2001.- chapter 45.
3. Sieber M., Engert A., Diehl V.// Ann. Oncol. - 2000 – 11 (Suppl.1) – P. 81-85.
4. Демина Е.А., Ткачев С.И., Трофимова О.П. с соавт. Материалы VIII Российского онкологического конгресса, Москва, ноябрь 2004, стр121-125.
5. Bailliere’s Clinical Haematology. International Practice and Research. Hodgkin’s Disease. Guest editor V. Diehl. - 1996.
6. Jerusalem G., Beguin Y., Fassotte M.F. et al Ann. of Oncol. 2003, 14, 123-130.
7. Franklin J. & Diehl V. // Ann. Oncol. – 2002 – 13(Suppl 1) – P. 98-101.
8. 25 Years German Hodgkin Study Group. Ed. by Diehl V., Josting A. Medizin & Wissen, Munih, 2004.