А.В. Голанов, С.Р. Ильялов, В.В. Костюченко, И.Н. Пронин
НИИ нейрохирургии им. Н.Н. Бурденко РАМН, Москва
Лечение больных с метастазами в головной мозг – это актуальная проблема современной нейрохирургии, онкологии, радиологии и химиотерапии. Количество пациентов с метастатическим поражением мозга ежегодно растет. Только в США регистрируется более 100000 новых пациентов в год. Число вновь диагностируемых вторичных внутримозговых опухолей превышает количество первичных новообразований головного мозга почти в 5 раз. По статистике каждый третий больной раком легкого или молочной железы страдает от наличия церебральных метастазов, а при меланомах – 3 из 4 пациентов имеют подобную проблему (11). Развитие метастазов в головном мозге, вызывая физические и психические нарушения, приводит к быстрой инвалидизации больных.
К сожалению, прогноз для жизни пациентов с множественными метастазами в головной мозг в подавляющем большинстве случаев пессимистичен, и в среднем продолжительность жизни составляет около 12 месяцев практически при любом варианте лечения (9). Порог 2-летней выживаемости преодолевают только 8% таких больных (4). Однако качество жизни пациентов в течение этого периода времени сильно зависит от выбранной тактики лечения.
Крупные одиночные метастазы могут быть удалены хирургически, после чего пациенты практически всегда подвергаются облучению всего мозга. Тотальное удаление метастаза и/или улучшение клинического статуса больных по данным разных исследователей достигается в 33-97% случаев. Средняя выживаемость среди пациентов, подвергшихся нейрохирургическому лечению, значительно варьирует из-за преобладания разных типов опухолей в разных сериях и в среднем составляет 8,9 месяца. Летальность в течение 30 дней после операции достигает 8,4% (9). Наличие множественных и/или глубинно расположенных метастазов в подавляющем большинстве случаев является противопоказанием к нейрохирургическому вмешательству.
Медиана выживаемости пациентов, получивших в качестве лечения только облучение всего мозга (ОВМ), незначительно превышает 4 месяца с локальным контролем роста около 6 месяцев (3).
Сочетание хирургического лечения и последующего конвенционального облучения позволяет значительно снизить вероятность рецидива метастазов, но существенно не влияет на общую продолжительность жизни. Локальный контроль роста опухоли составляет около 75% в течение первого года после проведения лечения (8).
Стереотаксическая радиохирургия – метод лечения, предложенный известным шведским нейрохирургом Ларсом Лекселлом еще в 1951 г. Суть его заключается в применении стереотаксической техники для подведения высокой дозы лучевой энергии к интракраниально расположенному патологическому очагу за один сеанс с высокой степенью точности и без трепанации черепа. Лекселл разработал аппарат для стереотаксического облучения, который назвал «Гамма-ножом» (“Leksell Gamma Knife”®) за его высокую точность. В радиохирургии применяются также линейные и протонные ускорители. В настоящее время стереотаксическая радиохирургия «Гамма-ножом» (СРХГН) является методом выбора, «золотым стандартом» стереотаксической радиохирургии в лечении пациентов с метастазами в головном мозге, представляя собой малоинвазивную, высокоэффективную, безопасную и экономически выгодную методику с явными преимуществами перед другими методами лечения и успешно сочетаемую с ними в различных вариантах. Например, локальный контроль роста в течение 1 года составляет около 83%, что в сравнении с применением хирургии и радиотерапии имеет явное преимущество, хотя и без статистически достоверной разницы (7). Локальный контроль при сочетании СРХГН и ОВМ составляет около 36 месяцев (5).
В настоящее время в мире функционирует свыше 200 «Гамма-ножей», на которых прошли лечение свыше 300 тысяч пациентов с различными видами интракраниальной патологии, в т.ч. около 100 тыс. больных с церебральными метастазами. Лечение проводится с помощью 201 сфокусированного источника гамма-излучения радиоактивного кобальта-60. При этом излучение от каждого из них в отдельности не оказывает повреждающего действия на мозг, но сходясь в одной точке (изоцентр), они дают суммарное излучение, достаточное для того, чтобы вызвать желаемый биологический эффект в патологическом очаге. Это позволяет в большинстве случаев избежать лучевого повреждения здоровой мозговой ткани вне видимых границ опухоли. Доза облучения достаточно велика для того, чтобы достичь необходимого эффекта после однократной процедуры (длительность сеанса составляет от 15-20 минут до нескольких часов). Поэтому данный вид лучевого лечения называется радиохирургией, в отличие от радиотерапии – когда больному проводится до 30-40 сеансов небольшими дозами. Мощное излучение приводит к повреждению ДНК патологических клеток и клеточных мембран, вследствие чего нарушается безудержный рост опухоли. В стенках кровеносных сосудов происходит пролиферация эндотелия, вследствие чего просвет их сужается и вовсе закрывается. Таким образом, кардинальным образом изменяется кровоснабжение и, в конечном итоге, опухоль уменьшается, а в ряде случаев исчезает через некоторое время.
Основные варианты локализации первичных опухолей, метастазирующих в головной мозг, - меланома кожи, рак легкого, рак молочной железы, рак почки, рак кишечника.
Локальный контроль роста метастаза после СРХГН зависит от гистологического варианта опухоли. При этом наиболее неблагоприятным вариантом являются метастазы меланомы. Однако в целом гистологический вариант опухоли или количество очагов значимо не влияют на выживаемость. Ведущее значение здесь имеет распространенность экстракраниального поражения и эффективность его контролирующего лечения (5).
Основными критериями отбора больных для СРХГН являются:
Ограничение по диаметру очага, а соответственно и по его объему, обусловлено соображениями безопасности метода для пациента. На основании исследований, проведенных под эгидой RTOG (Radiation Therapeutic Oncology Group) 90-05, установлено, что в случае применения одинаковой предписанной дозы на очаги диаметром от 20 до 30 мм риск развития постлучевых реакций в 7,3 раза выше, чем при облучении очагов диаметром менее 20 мм. А в случае лечения очагов диаметром от 31 до 40 мм вероятность развития подобных осложнений выше в 16 раз (12).
Состояние пациента также важно в связи с тем, что больные с низкой оценкой по шкале Карновского имеют минимальные шансы на успешный результат СРХГН, а наличие симптомов дислокации мозга является прямым противопоказанием к радиохирургическому лечению.
Залогом успешного результата является контроль первичной опухоли и ее метастазов в другие органы, т.к. по статистике основной причиной смерти пациентов с церебральными метастазами, прошедших СРХГН, является прогрессия именно экстракраниальных очагов.
Противопоказаниями для СРХГН являются:
Важным в СРХГН церебральных метастазов является выбор адекватной дозы облучения. Протокол RTOG 90-05 для пациентов, имевших ранее ОВМ дозой 30 Гр, рекомендует для радиохирургии применение предписанной дозы (ПД – доза по краю опухоли) 24 Гр для очагов диаметром менее 20 мм и 18 Гр - для метастазов диаметром более 20 мм (12). Исследования, проведенные в Калифорнийском университете показали, что 1-годичная безрецидивная выживаемость после СРХГН достигает 90% при использовании ПД>18 Гр. В случае применения более низких ПД этот показатель снижается до 77% (13).
На основании данных ряда публикаций о лечении 1180 пациентов можно констатировать, что уровень локального контроля метастазов c применением «Гамма-ножа» составляет от 71% до 97%, причем у 91% этих больных (1075 человек) локальный контроль превышает 85%.
Клиническое наблюдение. Больная К., 35 лет. Диагноз: метастазы аденокарциномы сигмовидной и прямой кишки в левую лобную долю. Состояние после удаления метастаза из правого полушария мозжечка. Состояние после колопроктэктомии. Метастазы в левом легком, правой плевральной полости, л/у средостения. Метастаз в правой подвздошной кости. СРХГН 23.06.2005 г. (mts в лобной доле - предписанная доза 18 Гр, предписанная изодоза 37%; mts в мозжечке - предписанная доза 24 Гр, предписанная изодоза 50%).
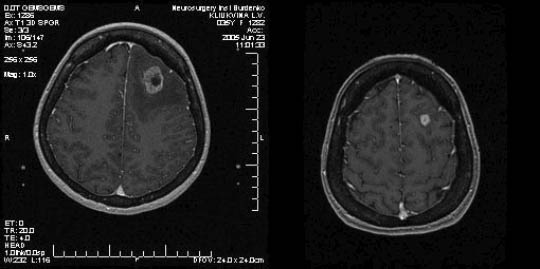
Рис. 1. Метастаз в левой лобной доле (диаметр 25 мм), выраженный перифокальный отек. Через 3 месяца отмечается уменьшение метастаза (диаметр 11 мм), редукция отека.
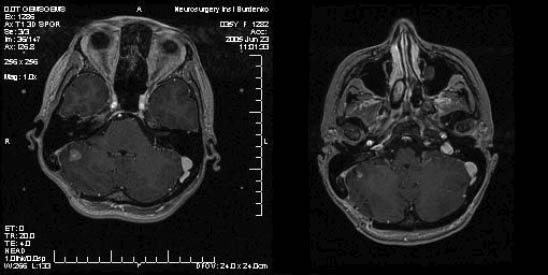
Рис. 2. Метастаз в правой гемисфере мозжечка (диаметр 12 мм). Через 3 месяца - уменьшение метастаза (диаметр 8 мм).
На сегодняшний день нет однозначного мнения по поводу комбинированного применения СРХГН и ОВМ. В большинстве исследований, хотя и отмечается более эффективный уровень локального контроля при сочетании этих методов, тем не менее, не выявлено статистически значимых различий в продолжительности жизни в сравнении с больными, получавшими только радиохирургическое лечение (1, 2, 14).
Основные виды возможных осложнений после СРХГН – постлучевые реакции (ПЛР) в виде развития отека в зоне облучения с возможным увеличением как самого очага, так и зоны перифокального отека, а также формирование внутримозговых кист. Частота развития ПЛР составляет около 4% (6). Дифференциальный диагноз между продолженным ростом метастаза и ПЛР невозможен с применением обычных диагностических опций, таких как КТ/МРТ с контрастным усилением. Дело в том, что визуально и то и другое выглядит одинаково как зона накопления контраста с перифокальным отеком. Однако в случае применения позитронно-эмиссионной томографии (ПЭТ) с фтор-дезокси-глюкозой (ФДГ) выявляются существенные различия. Зона ПЛР будет соответствовать области снижения метаболизма ФДГ в отличие от продолженного роста очага, где будет выявляться повышенное усвоение ФДГ. ПЛР развиваются, как правило, в течение первых 3-6 месяцев после СРХГН. Внутримозговые кисты могут образовываться через несколько лет после лечения. Дифференциальный диагноз между кистой и продолженным ростом метастаза проводится также на основании ПЭТ (6). В случае, когда эти кисты не вызывают так называемого масс-эффекта на прилежащие мозговые структуры и не проявляют себя очаговым неврологическим дефицитом или судорожной активностью, они не требуют какого-либо нейрохирургического лечения.
Таким образом, суммируя данные литературы, можно заключить, что СРХГН является высокоэффективным и достаточно безопасным методом лечения пациентов с метастазами рака различной локализации в головной мозг, позволяющим сохранять качество жизни данных больных на высоком уровне в течение всего периода болезни.
Список литературы:
1. Chen JCT, O’Day S, Morton D, Essner R, Cohen-Gadol A, MacPherson D, Giannotta SL, Petrovich Z, Yu C, Apuzzo M// Stereotactic radiosurgery in the treatment of metastatic disease to the brain//Stereotact. Funct. Neurosurg. 73(1-4), 1999.
2. Chidel MA, Suhl JH, Reddy CA, Chao ST, Lundbeck MF, Barnett GH: Application of recursive partitioning analysis and evaluation of the use of whole brain radiation among patients treated with stereotactic radiosurgery for newly diagnosed brain metastases// Int. J. Radiat. Oncol. Biol. Phys. Jul 1; 47(4).
3. Gaspar L et al: Int. J. Oncol. Biol. Phys. 37(4), 1997.
4. Hall WA et al: Long-term survival with metastatic cancer to the brain// Med. Oncol. Nov; 17(4): 279-86, 2000.
5. Kondziolka D, Patel A, Lunsford LD, Kassam A, Flickinger JC// Stereotactic radiosurgery plus whole brain radiotherapy versus radiotherapy alone for patients with multiple brain metastases [see comments]// Int. J. Radiat. Oncol. Biol. Phys. 45 (2) p427-34, 1999.
6. Lippitz B //An Introduction to Gamma Knife Surgery. Radiosurgical treatment of Cerebral Metastases// Published by Bodo Lippitz Sept 2002. Printed in Sweden). 1, 47(4), 2000.
7. Muacevic A, Kreth FW, Horstmann GA, Schmid-Elsaesser R, Wowra B, Steiger HJ, Reulen HJ// Surgery and radiotherapy compared with gamma knife radiosurgery in the treatment of solitary cerebral metastases of small diameter//J. Neurosurg. Jul 91(1): 35-43, 1999.
8. Patchell et al: JAMA Nov 4; 280(17); 1485-9, 1998.
9. Prasad D. //Gamma Knife Surgery and Microsurgery: a comparison of published results// University of Virginia, December 2002, 647-54, 1996.
10. Rutigliano MJ, Lunsford LD, Kondziolka D, Strauss MJ, Khanna V, Green M. The cost effectiveness of SRS versus surgical resection in the treatment of solitary metastatic brain tumors. Open Surgery, 37(3): 445-453, 1995.
11. Shaw E et al: Int. J. Radiol. Oncol. Biol. Phys. Vol. 34, № 3.
12. Shaw E et al: Int. J. Radiol. Oncol. Biol. Phys. 47(2), 2000.
13. Shiau CY, Sneed PK, Larson D et al. //Int. J. Radiol. Oncol. Biol. Phys. Jan 15; 37(2), 1997.
14. Sneed PK, Lamborn KR, Forstner JM, McDermott MW, Chang S, Park E, Gutin PH, Phillips TL, Wara WM, Larson DA: Radiosurgery for brain metastases: is whole brain radiotherapy necessary// Int. J. Radiat. Oncol. Biol. Phys. 43 (3) p. 549-58, 1999.