МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ И ИММУНОЛОГИЧЕСКИЕ МЕТОДЫ В ПРАКТИЧЕСКОЙ ДИАГНОСТИКЕ РАКА ШЕЙКИ МАТКИ
С.А. Сельков, Г.Н. Веденеева, С.В. Рищук
ГУ НИИАГ им. Д.О. Отта РАМН, Санкт-Петербург
Рак шейки матки (РШМ) занимает ведущее место в структуре женской онкологической заболеваемости и смертности в развивающихся странах и стабильное третье-четвертое место (после рака молочной железы, рака яичников, рака эндометрия) в экономически развитых странах [1]. В целом по распространенности РШМ занимает второе место после рака молочной железы. По данным ВОЗ ежегодно в мире регистрируется около 450 тыс. новых случаев РШМ [2]. Ежегодно только в странах Европейского сообщества отмечается более 25 тыс. новых случаев заболеваний и около 12 тыс. летальных исходов, связанных с РШМ [3]. В последние годы в экономически развитых странах отмечен рост заболеваемости РШМ среди женщин молодого и среднего возраста [2].
В России в настоящее время ежегодная заболеваемость РШМ составляет 14,9 на 100 тыс. женщин [5]. В Санкт-Петербурге среди злокачественных новообразований женских гениталий РШМ занимает третье место после рака эндометрия и рака яичников, тогда как в России в целом остается на втором, уступая только раку эндометрия [6]. Более 40% женщин с установленным диагнозом инвазивного РШМ умирают от прогрессирования заболевания в течение первых 5 лет с момента установления диагноза [7].
В сложной и разветвленной проблеме РШМ центральное место занимают три основных направления:
Особенно актуальным для РШМ является первое положение. Для РШМ, как ни для какого вида опухолей, разработаны методы скрининговой диагностики, позволяющие диагностировать неопластические процессы уже на самых ранних стадиях. При этом развитие одного из самых важных – цитологического метода - позволило еще в 60-е годы утверждать, что в ближайшем будущем женщины не должны умирать от РШМ, поскольку неопластические процессы будут выявляться на самых ранних доинвазивных стадиях.
Важной предпосылкой для реализации этого положения является разработка и внедрение вирусологических и молекулярно-биологических методов диагностики, позволяющих определить онкогенные папилломавирусы.
Большое внимание в последние годы уделяется и иммунологическим аспектам возникновения РШМ, поскольку одной из основных функций иммунной системы является элиминация опухолевых клеток.
В настоящее время считается общепризнанной роль онкогенных папилломавирусов (HPV) в этиопатогенезе РШМ. При многочисленных мультицентровых обследованиях женщин, страдающих РШМ, инфицированность онкогенными папилломавирусами наблюдалась более чем в 95% случаев [8, 9].
Онкогенный потенциал папилломавирусов существенно варьирует. По способности инициировать диспластические (предраковые) процессы и рак аногенитальной области папилломавирусы условно разделены на группы «высокого» (16, 18, 45, 30), «среднего» (31, 33, 35, 51, 52, 58) и «низкого» (6, 11, 42, 43, 44) риска. При этом основную роль играют HPV 16 и 18 типов, встречающиеся в 50–70% и 10–20% случаев РШМ соответственно [10].
Решающее значение для развития РШМ имеет персистенция вирусного генома. Вирусные ДНК способны персистировать в клетке в эписомальной и интегративной формах. В тканях эпителиальных дисплазий шейки матки обнаруживаются эписомальные формы ДНК HPV. В большинстве случаев РШМ и в клеточных линиях, полученных из РШМ и содержащих HPV, вирусные последовательности определяются в интегрированной форме. Имеются сообщения об обнаружении вирусной ДНК в клетках РШМ как в интегрированной, так и в эписомальной формах [11].
Теоретические и экспериментальные исследования, посвященные роли HPV в развитии РШМ, дали толчок для разработки практических подходов, связанных с использованием молекулярно-биологическх методов ранней диагностики РШМ. К ним, прежде всего, относятся полимеразная цепная реакция (ПЦР) с типоспецифическими и видоспецифическими праймерами и так называемая молекулярная гибридизация II поколения (Hybrid Capture II).
Основным принципом ПЦР является многократное копирование определенного участка вирусной ДНК, что позволяет визуализировать продукты реакции в электрофорезе в полиакриламидном или агарозном геле при окраске бромистым этидием и подсветке ультрафиолетом.
Основным принципом Hybrid Capture II является формирование специфических ДНК-ДНК гибридов, улавливаемых антителами, фиксированными на лунках планшета. Использование хемилюминесцентной метки позволяет проводить не только качественную, но и количественную оценку результатов.
Полученные нами данные, представленные в табл. 1, свидетельствуют о разной чувствительности этих методов [12].
Таблица 1.
Частота инфицирования онкогенными типами HPV по данным обследования методом Hybrid Capture II и ПЦР.
| Метод диагностики | Hybrid Capture II | ПЦР | ||
|---|---|---|---|---|
| Группы больных | Количество больных | HPV (+) | Количество больных | HPV (+) |
| 1 группа | 413 | 119 (28,8%) | 181 | 66 (36,5%) |
| 2 группа | 57 | 4 (7%) | 78 | 9 (11,5%) |
| Всего: | 470 | 123 (26,2%) | 259 | 75 (28,9%) |
Наш опыт использования молекулярно-биологических методов для выявления папилломавирусов позволяет дать их сравнительную оценку. Так, ПЦР, обладая большей чувствительностью, несколько чаще дает так называемые ложно-позитивные результаты. В то же время, молекулярная гибридизация II поколения при большей ее технологичности до настоящего времени остается весьма дорогостоящим методом, так и не получившим широкого распространения в нашей стране.
Перспективным для изучения различных генов папилломавирусов, участвующих в злокачественной трансформации, является так называемый «real time» ПЦР метод. Его принцип заключается в количественной оценке экспрессии тех или иных генов, что может иметь важное прогностическое значение.
Одним из ключевых положений, характеризующих молекулярные механизмы опухолевой трансформации при инфицировании онкогенными папилломавирусами, является оценка экспрессии генов Е2 и Е6 [13]. Использование количественной ПЦР в реальном времени с целью анализа физического состояния ДНК HPV позволило высказать следующее допущение:
Несмотря на несомненную теоретическую и диагностическую ценность молекулярно-биологических методов диагностики папилломавирусной инфекции, «золотым стандартом», безусловно, остается цитологический метод. Профилактика и ранняя диагностика РШМ шейки матки включает два этапа:
Успех цитологического скрининга рака шейки матки зависит от его организации. До настоящего времени не решен вопрос о возрастном составе населения, подлежащего цитологическому скринингу, и периодичности его проведения. В различных странах интервалы между скринингами колеблются от 1 года до 5 лет. По нашему мнению, интервал между цитологическими скринингами не должен превышать 2-3 лет, и обследование должны проходить все женщины с возраста начала половой жизни, оптимально - с 20 до 65 лет.
Эффективность цитологического скрининга во многом зависит от его чувствительности и колеблется от 66% до 83% [14]. Причиной ложноотрицательных ответов остается не столько ошибочная интерпретация цитологических данных, сколько плохой забор материала для цитологического исследования. Не менее важным является проведение второго этапа обследования, а именно прицельной биопсии в случае обнаружения патологии при цитологическом исследовании [15].
В определенной степени цитологический и молекулярно-биологический методы сближает иммуноцитохимический (ИЦХ) метод, основанный на определении капсоидных белков HPV с помощью моноклональных антител S33 и Т16. Распознаваемый моноклональным скрининговым антителом S33 эпитоп консервативен и дает возможность идентификации почти всех типов HPV. Эпитоп, распознаваемый моноклональным антителом Т16, напротив, консервативен для HPV 16 и 18 типов, имеющих склонность к злокачественной трансформации эпителия. Эффективность иммуноцитохимического исследования для оценки активной фазы папилломавирусной инфекции была сопоставлена нами с помощью еще одного молекулярно-биологического метода – так называемой обратно транскриптазной ПЦР (ОТ ПЦР) (табл. 2).
Для пациенток с положительными результатами иммуноцитохимического исследования прогрессия CIN более вероятна, чем элиминация HPV и регрессия дисплазии.
Таким образом, определение активной фазы папилломавирусной инфекции может служить дополнительным критерием прогрессирования дисплазий и поводом для более энергичных методов терапии [16].
Следует отметить, что развитие РШМ – вероятностный процесс, зависящий не только от инфицирования онкогенными папилломавирусами но и от целого ряда экзо- и эндогенных факторов. Безусловно, среди эндогенных сопутствующих факторов важнейшее значение имеет фоновая патология шейки матки, предрасполагающая к персистированию папилломавирусов. Полученные нами данные свидетельствуют о высокой ее частоте у женщин, инфицированных онкогенными типами папилломавирусов (табл. 3) [17].
Таблица 2.
Оценка эффективности ИЦХ и ОТ ПЦР при определении репродуктивной фазы HPV-инфекции.
| Группы | Скрининг | HPV 16/18 | ||||
|---|---|---|---|---|---|---|
| ПЦР (+) | ИЦХ (+) | ОТ ПЦР(+) | ПЦР (+) | ИЦХ (+) | ОТ ПЦР (+) | |
| Без атипии | 3 (7,5%) | 1 (33,3%) | 2 (66,7%) | 2 (28,6%) | 1 (50,0%) | 1 (50,0%) |
| CIN I | 17 (42,5%) | 5 (29,4%) | 9 (53,0%) | 15 (45,5%) | 5 (33,3%) | 6 (40,0%) |
| CIN II | 8 (20,0%) | - | - | 5 (45,5%) | - | - |
| CIN III | 4 (10,0%) | - | - | 3 (37,5%) | - | - |
| Ca in situ | 8 (20,0%) | - | - | 7 (70,0%) | - | - |
| Всего | 40 (100,0%) | 6 (15,0%) | 11 (27,5%) | 32 (46,4%) | 6 (18,75%) | 7 (21,9%) |
Таблица 3.
Характер фоновой цервикальной патологии у обследованных женщин.
| Фоновая цервикальная патология | ОТ ПЦР (+)(n=215) | ОТ ПЦР (-)(n=170) | P | ||
|---|---|---|---|---|---|
| n | M±m% | n | M±m% | ||
| Эндоцервицит | 49 | 22,8±5,6% | 40 | 23,5±6,4% | >0,1 |
| Эрозированный эктропион | 147 | 68,4±6,2% | 90 | 52,9±7,5% | <0,01 |
| Лейкоплакия | 12 | 5,6+3,2% | 7 | 4,1±2,9% | >0,1 |
| Всего: | 208 | 96,7±2,3% | 137 | 80,6±5,6% | <0,001 |
Все большее внимание в последние годы уделяется состоянию иммунной системы при различных формах онкологической патологии, а также разработке методов терапии, основанных на использовании надзорных функций иммунитета. К сожалению, следует признать, что эти исследования в большинстве случаев все еще остаются в экспериментальной стадии. И даже наиболее перспективные из них, например, создание противоопухолевых вакцин на основе дендритных клеток, еще ожидает долгий путь внедрения в клиническую практику. Вместе с тем, нельзя отрицать важную прогностическую ценность изучения некоторых параметров иммунной системы, имеющих отношение к противоопухолевому иммунитету. Среди них, конечно, в первую очередь следует упомянуть систему интерферонов и цитотоксических клеток.
Полученные нами данные свидетельствуют о существенных изменениях цитотоксической активности так называемых NK-клеток (натуральных киллеров). У женщин, инфицированных онкогенными папилломавирусами, наблюдалось прогрессирующее снижение цитотоксического индекса NK-клеток, коррелирующее со степенью изменений цервикального эпителия и максимально выраженное при раке шейки матки.
Еще более показательными были изменения интерферонового статуса, характеризующиеся снижением способности к продукции как α/β, так и γ-интерферонов.
Таблица 4.
Состояние системы интерферона у обследованных женщин.
| Группа больных | HPV (+) (n=77) | HPV (-) (n=45) | ||||||
|---|---|---|---|---|---|---|---|---|
| n | IFN | IFN-α/β | IFN-γ | n | IFN | IFN-α/β | IFN-γ | |
| Гинекологически здоровые | 4 | 19,7 | 185,3 | 93,9 | 8 | 20,5 | 172,6 | 107,7 |
| Экстрацервикальная патология | 22 | 21,6 | 169,3 | 78,6 | 23 | 20,5 | 156,6 | 81,3 |
| Фоновая цервикальная патология | 31 | 22,5 | 171,2 | 76,3 | 12 | 22 | 149,2 | 61,2 |
| Предраковая патология | 6 | 22,7 | 142,9 | 50 | 2 | 24,2 | 112,5 | 42,8 |
| Раковая патология | 14 | 25,3 | 113,7 | 49,2 | 0 | - | - | - |
Следует отметить, что оценка интерферонового статуса может служить не только дополнительным прогностическим критерием прогрессирования патологии шейки матки, но и основанием для назначения вспомогательной иммуноориентированной терапии, в частности с использованием генно-инженерных интерферонов и индукторов интерферонов [17].
В заключение нам бы хотелось представить алгоритм обследования женщин с целью профилактики и раннего выявления РШМ (схема 1).
Необходимо обратить внимание на пациенток с дисплазиями по данным цитологического исследования и отсутствием HPV в ПЦР. Эта группа женщин всегда должна настораживать специалистов в плане возникновения преинвазивного и инвазивного рака, т.к. отрицательные результаты определения папилломавируса даже высокочувствительными лабораторными методами не всегда свидетельствуют о его отсутствии в макроорганизме. Причиной указанного феномена может быть погрешность в заборе материала, возникновение дисплазии, обусловленной редкими серотипами HPV, не идентифицирующимися в используемых тест-системах.
Особое внимание заслуживают пациентки с латентными формами папилломавирусной инфекции, вызванной онкогенными серотипами (без онкоцитологических признаков дисплазии РШМ). Основной задачей, на наш взгляд, в этом случае является оценка активности папилломавирусной инфекции по тестам, определяющим репликацию, а также по количественному тесту, оценивающему вирусную нагрузку. Известно, что возникновению интегрированных форм и запуску онкогенеза всегда предшествует репликация вирусного генома. Поэтому эта группа больных требует иммуномодулирующей терапии для стабилизации системы иммунитета и перевода инфекции в неактивную латентную форму. Хотелось бы обратить внимание на высокую значимость определения интеграции вирусного генома в клеточный геном эпителия шейки матки.
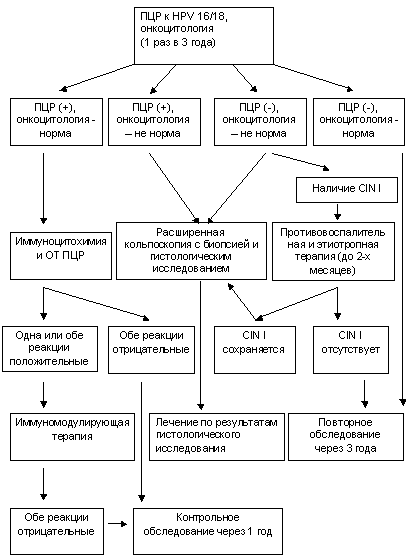
Схема 1.
Алгоритм обследования с целью профилактики и раннего выявления РШМ
Таким образом, профилактика РШМ базируется на своевременном выявлении и лечении предраковых патологических процессов на шейке матки, определении группы риска по папилломавирусной инфекции, играющей одну из главных ролей в канцерогенезе, а также тщательном диспансерном наблюдении за указанным контингентом больных.
Список литературы: