05.04.2024

Современный стандарт лечения распространенного мелкоклеточного рака легкого (МРЛ) продиктован результатами исследования IMpower133 и заключается в проведении 4 курсов противоопухолевой терапии на основе препаратов платины, этопозида и ингибитора контрольных точек (ИКТ) атезолизумаба [1]. Комбинированная терапия позволила увеличить медиану общей выживаемости (ОВ) до 12,3 мес. по сравнению с 10,3 мес. в группе химиотерапии по схеме EP (ОР 0,70; 95% ДИ 0,54-0,91; p=0,007), а медиану выживаемости без прогрессирования (ВБП) – до 5,2 мес. против 4,3 мес. (ОР 0,77; 95% ДИ 0,62-0,96; p=0,02).
В феврале 2024 года были опубликованы дополненные результаты рандомизированного исследования III фазы CASPIAN, исследовавшего возможности применения комбинации схемы EP с ИКТ дурвалумабом (анти- PD-L1) ± тремелимумабом (анти-CTLA-4) у пациентов с различной экспрессией PD-L1 и мутационной нагрузкой (tumor mutational burden, TMB). Работа включила 805 пациентов с распространенным МРЛ без предшествующего лечения в анамнезе, рандомизированных в группы EP с дурвалумабом (группа A, n=268), EP с дурвалумабом и тремелимумабом (группа B, n=268) и EP (контрольная группа, n=269). В качестве первичной конечной точки была выбраны общая выживаемость (ОВ), а вторичные конечные точки включали выживаемость без прогрессирования и частоту объективных ответов (ЧОО). Дизайн исследования предполагал использование мощности в 96% и показателя ошибки первого рода (𝛼) ≤0,04.
Первые результаты исследования опубликовали еще в 2019 году, а обновленные данные были представлены в 2022 году. Авторы продемонстрировали увеличение медианы ОВ в группе A до 12,9 мес. по сравнению с 10,5 мес. в контрольной группе (ОР 0,71; 95% ДИ 0,60-0,86; p=0,0003) и 3-летней ОВ до 17,6% против 5,8% соответственно (рис.1).
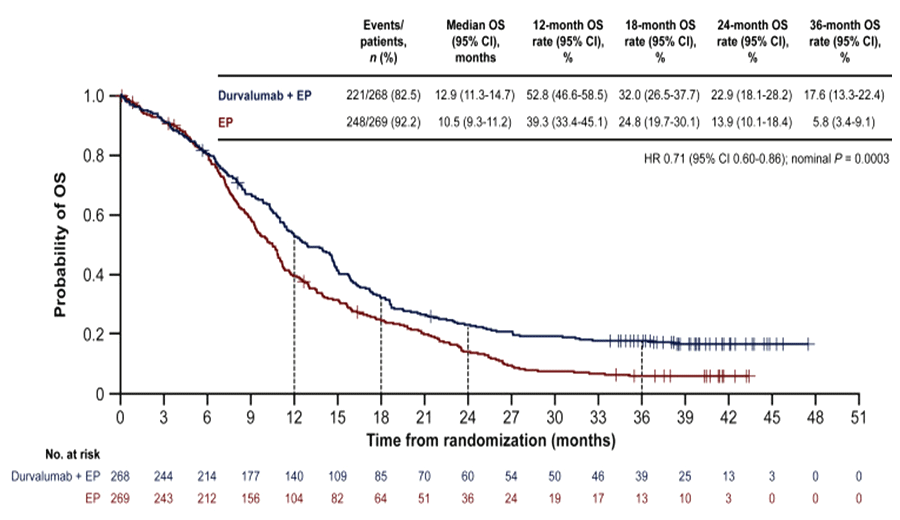
Рисунок 1. Общая выживаемость в группе EP с дурвалумабом в исследовании CASPIAN.
Добавление к комбинации EP и дурвалумаба ингибитора CTLA-4 тремелимумаба, в свою очередь, не приводило к достоверному улучшению отдаленных результатов лечения с медианой ОВ в 10,4 мес. в группе B против 10,5 мес. в контрольной группе (ОР 0,82; 95% ДИ 0,68-1,00; p=0,045) [2]. При этом промежуточный анализ, опубликованный в 2021 году, показал, что 3-летняя ОВ в группе B составила 15,3% (ОР 0,81; 95% ДИ 0,67-0,97; p=0,0200). Подобный результат заметно выше аналогичного в контрольной группе, однако по-прежнему не превосходит комбинацию EP и дурвалумаба без добавления анти-CTLA-4 агента. Более того, применение комбинации двух ингибиторов контрольных точек с EP характеризовалось достоверным увеличением частоты нежелательных явлений (НЯ) 5 ст. и аутоиммунных нежелательных явлений 3-4 ст. соответственно до 10% и 14% по сравнению с 5% и 5% в группе A и 6% и <1% в контрольной группе. Частота общих НЯ 3-4 ст. между группами оставалась на сопоставимом уровне (группа А – 60%, группа B – 63%, контрольная группа – 59%).
Таким образом, добавление тремелимумаба к комбинации EP и дурвалумаба не приводит к достоверному улучшению общей выживаемости и сопровождается увеличением риска развития летальных или аутоиммунных осложнений, что делает данную комбинацию нецелесообразной и малоприменимой в общей популяции больных.
Попытки дополнительно сузить показания для назначения высокотоксичной терапии в рамках дальнейшего изучения искомой популяции позволили авторам проанализировать влияние на результаты лечения таких факторов, как экспрессия PD-L1 и статус TMB [3]. Для оценки PD-L1 авторы использовали антитело SP263 и систему VENTANA, а анализ проводился по показателям экспрессии на клетках опухоли (tumor cells, TC) и иммунных клетках (immune cells, IC). Показатель TMB оценивался с помощью системы FoundationOne, а для стратификации использовался показатель TMB >10 мутаций на мегабазу, поскольку именно данное значение ассоциировалось с достоверным увеличением эффективности двойной иммунной блокады при НМРЛ [4]. Для итоговой оценки PD-L1 и TMB были доступны данные 54,4% и 35,2% пациентов соответственно (biomarker-available population, BEP).
Авторы показали, что экспрессия PD-L1 >1% определялась у 5,7% пациентов на опухолевых клетках (TC) и у 25,8% пациентов на иммунных клетках (IC). При исследовании корреляции экспрессии PD-L1 и эффективности терапии по схеме EP + дурвалумаб (группа А) не было выявлено достоверных различий между группами PD-L1 ≥1% и <1% (рис.2а).
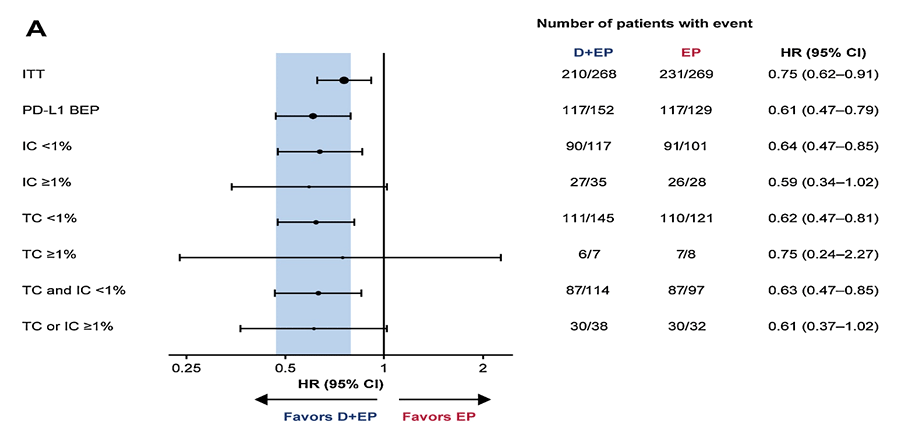
Рисунок 2а. Влияние экспрессии PD-L1 на эффективность терапии по схеме EP + дурвалумаб.
В группе EP + дурвалумаб + тремелимумаб (группа B) экспрессия PD-L1 >1%, напротив, ассоциировалась с улучшением показателя ОВ по сравнению с химиотерапией по схеме EP: ОР в группе B при TC ≥1% и IC ≥1% составило 0,42 и 0,53 против 0,76 и 0,88 в группе контроля (рис.2b).
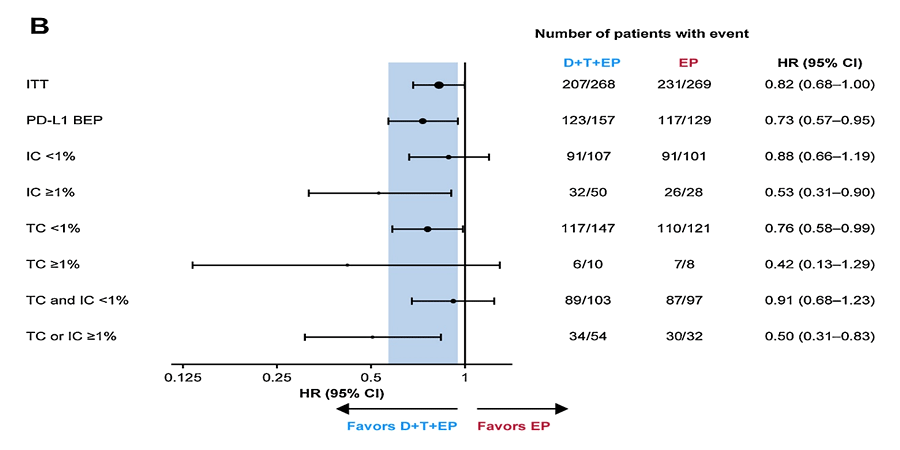
Рисунок 2b. Влияние экспрессии PD-L1 на эффективность терапии по схеме EP + дурвалумаб + тремелимумаб.
Более того, именно положительная экспрессия PD-L1 являлась фактором, определяющим наибольшую эффективность добавления тремелимумаба к комбинации EP + дурвалумаб, что было подчеркнуто при построении кривых выживаемости Каплана-Майера (рис.3). Тем не менее, полученные данные являются результатом post-hoc анализа. Авторы упоминают об определенной разнородности сравниваемых выборок ввиду разного функционального статуса, а также различной распространенности и локализации метастазов на момент начала терапии, что требует дальнейших исследований. Количество мутаций на мегабазу, в отличие от экспресии PD-L1, не оказывало достоверного влияния на эффективность терапии ни в одной из групп (группа А против EP: p=0,916; группа B против EP: p=0,672) и не коррелировало с экспрессией PD-L1. Так, частота одновременного наличия IC ≥1% и TMB ≥10 мутаций на мегабазу не превышала 11,6%, что предполагает отсутствие достоверной связи между данными маркерами.
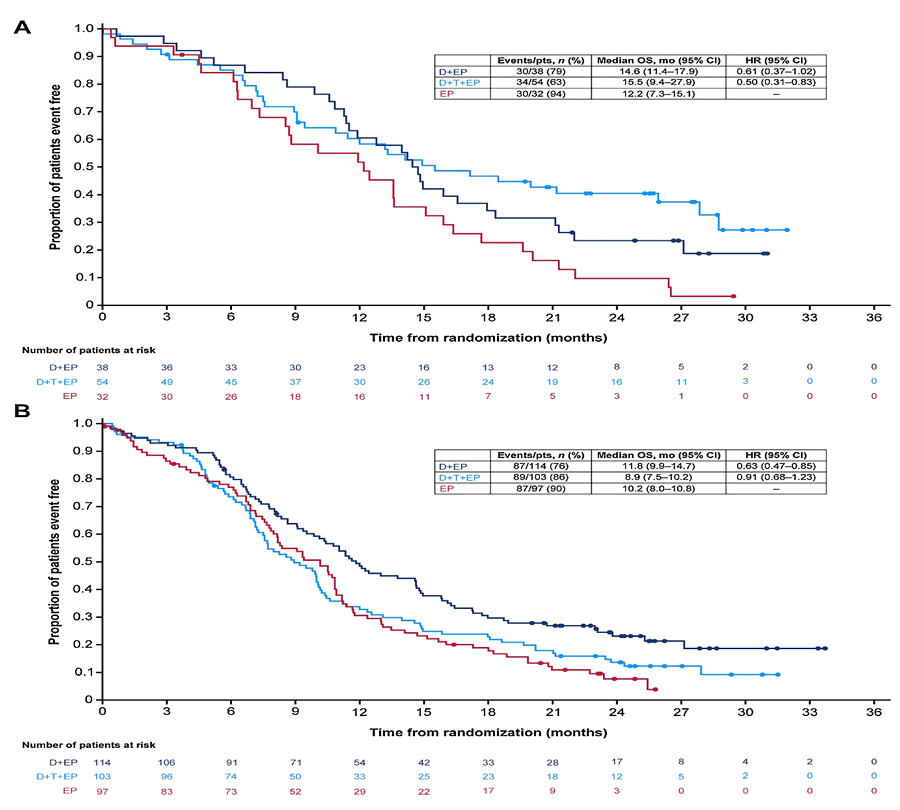
Рисунок 3. Общая выживаемость в группах с различной экспрессией PD-L1.
Таким образом, применение комбинации EP и дурвалумаба является эффективным методом противоопухолевой терапии в первой линии лечения распространенного мелкоклеточного рака легкого независимо от статуса PD-L1 и мутационной нагрузки. Добавление к данной схеме ингибитора CTLA-4 тремелимумаба не приводит к достоверному увеличению общей выживаемости в общей популяции, но может ассоциироваться с улучшением отдаленных результатов лечения среди пациентов с PD-L1 >1%. Тем не менее, ввиду ограниченности представленных результатов и высокого риска осложнений на фоне двойной иммунной блокады данное предположение требует предварительного подтверждения в рамках отдельного исследовательского протокола.
Источники: