08.04.2020

Введение
Почечно-клеточный рак (ПКР) наравне с меланомой традиционно считается моделью для изучения новых подходов иммунотерапии. Еще в 2000-х годах предполагалось, что комбинация двух иммунных препаратов – в то время цитокинов – позволит увеличить общую эффективность лечения [1]. В исследованиях предпринимались неоднократные попытки сочетать интерферон и интерлейкин-2 в различных режимах, однако результаты зачастую оказывались настолько противоречивыми, что монотерапия цитокинами так и осталась стандартом того времени [2]. Вторым направлением было изучение комбинаций цитокинов, колониестимулирующих факторов с вакцинами, что тоже не привело к значимому результату.
Спустя десятилетие иммунотерапия сделала новый виток: появились ингибиторы контрольных точек, блокирующие рецепторы-супрессоры или их лиганды на лимфоцитах и опухолевых клетках. Вместе с тем, появились надежды на комбинации нескольких ингибиторов контрольных точек.
Рак почки стимулирует и подавляет иммунную систему
Известно, что ПКР является иммуногенной опухолью. С одной стороны, опухолеассоциированные антигены, находящиеся на клетках рака почки, активируют специфический иммунитет [3]. С другой стороны, система регуляторных механизмов приводит к иммуносупрессии и дезактивации развивающегося противоопухолевого ответа [4]. Ранее было показано, что присутствие иммунных контрольных точек обуславливает агрессивный фенотип ПКР. В частности, экспрессия рецепторов PD-1 и CTLA-4 на клетках, как первичной опухоли почки, так и метастазов, приводит к худшим показателям общей выживаемости больных метастатическим ПКР [5-7]. Также были описаны два агрессивных фенотипа, связанных с лимфоцитами: CD8+PD-1+Tim-3+Lag-3+ и CD25+CD127-Foxp3+/Helios+GITR+ [8]. Примечательно, что чем больше контрольных точек задействовано, тем агрессивнее течение болезни. Еще в 2009 году Blackburn с соавторами показали, что в отсутствие иммуносупрессорных молекул лимфоцит продуцирует большие количества интерферона-гамма и фактора некроза опухоли, являющиеся показателями активности иммунной клетки [9]. При включении двух контрольных точек активность лимфоцита снижается в 2 раза по сравнению с одной и в 3 раза по сравнению с лимфоцитом без инициированных контрольных точек (рисунок 1). Различия в продукции интерферона лимфоцитом между двумя и тремя активными контрольными точками уже достоверно не определяются. Следовательно, можно предположить, что блокада двух контрольных точек является принципиально значимой для активации иммунной системы.
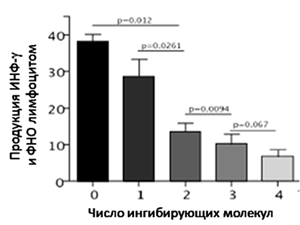
Рисунок 1. Снижение активности лимфоцита при активации ингибирующих молекул (количество от 0 до 4).
Blackburn et al. Nature Immunology 2009 (адаптировано).
Успех иммунотерапии был предопределен в 2015 году
Пять лет назад были опубликованы первые результаты рандомизированного исследования 3 фазы CheckMate 025, в котором изучался ниволумаб [10]. Ниволумаб является моноклональным антителом, действующим на рецептор PD-1. Связывая этот рецептор, ниволумаб приводит к активации лимфоцитов, которые находят опухолевые клетки и поражают их.
В исследовании CheckMate 025 принял участие 821 пациент с метастатическим ПКР и прогрессированием заболевания на первой или второй линии терапии антиангиогенными препаратами. Пациенты были рандомизированы в 2 группы, одна из которых получала ниволумаб (3 мг/кг, внутривенно, каждые 2 недели), а вторая – эверолимус (10 мг внутрь ежедневно).
Основным критерием эффективности была общая выживаемость. Помимо этого проводили оценку объективного ответа, выживаемости без прогрессирования и безопасности применения препарата.
На GU ASCO в 2020 году авторы продемонстрировали окончательные результаты исследования CheckMate 025. Впервые у пациентов с метастатическим ПКР, получавших ингибитор контрольных точек, была проанализирована долгожданная 5-летняя общая выживаемость, которая составила 26%, а ее медиана – 25,8 месяца [11]. Такие показатели, в 2-3 раза превышающие как российские, так и американские результаты, несомненно, впечатляют. Так, в российском исследовании RENSUR5 5-летняя общая выживаемость составила 8,2% (медиана 11 месяцев) [12], а в американской базе SEER – 12% (рисунок 2) [13]. Следует отметить, как в RENSUR5, так и в SEER анализировались пациенты с впервые выявленным распространенным ПКР, в то время как в CheckMate 025 включались пациенты с прогрессированием болезни на стандартной терапии, и даже в этой ситуации результат был лучше.
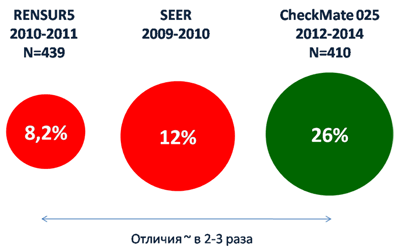
Рисунок 2. Непрямое сравнение показателей 5-летней выживаемости в российском исследовании RENSUR5,
американской базе данных SEER и исследовании CheckMate 025 (указаны годы включения пациентов).
Частота объективных ответов также была удовлетворительной – 23%. В случае развития ответа на лечение медиана продолжительности ответа составила 18,2 месяца. Медиана выживаемости без прогрессирования была 4,2 месяца.
Нежелательные явления 3-4 степени были зарегистрированы у 19% больных, получавших ниволумаб [10]. За 5 лет частота этих нежелательных явлений увеличилась лишь до 21%, что теоретически свидетельствует об отсутствии долгосрочной токсичности. Из всех нежелательных явлений 3-4 степени у больных из группы ниволумаба чаще всего была усталость (2%). Среди других нежелательных явлений у больных, получавших ниволумаб, были отмечены кашель, тошнота, сыпь, одышка, диарея, запор, снижение аппетита, боли в спине и суставах. С течением времени кардинальных изменений различных видов токсичности также не наблюдалось.
Следовательно, ниволумаб в монотерапии оказался в 5 раз более эффективной терапевтической опцией при токсичности меньшей, чем у таргетных препаратов. Первые результаты этого исследования послужили основанием для разработки комбинации для использования в первой линии терапии.
Настоящее. Двойная иммунотерапия в первой линии
Логичным было после успеха иммунотерапии у пациентов с прогрессированием болезни на традиционных таргетных препаратах изучить эффективность нового метода в первой линии терапии. Более того, целесообразным представлялось использование комбинации ингибиторов, блокирующих две контрольные точки – PD-1 и CTLA-4. Поскольку первая линия терапии вносит максимальный вклад в общую выживаемость пациентов с метастатическим ПКР, и зная, что есть достоверное влияние на продолжительность жизни во второй линии, можно было предположить, что ниволумаб в комбинации с ипилимумабом существенно улучшат общий результат лечения впервые выявленного метастатического рака почки. Наконец, предположим, что если у пациента появились метастазы, то опухолевые клетки ускользнули от иммунного надзора и, следовательно, нужно оказать незамедлительное воздействие на иммунную систему в первой же линии терапии.
В регистрационном рандомизированном исследовании 3 фазы CheckMate 214 [14] не получавшие ранее терапию по поводу светлоклеточного метастатического ПКР пациенты были рандомизированы в группу ниволумаба в комбинации с ипилимумабом (N=550) или в группу сунитиниба, выбранного в качестве препарата сравнения (N=546). Исследование было спланировано так, чтобы оценить эффективность терапии в группе промежуточного и плохого прогноза согласно критериям IMDC. Ниволумаб использовался в дозе 3 мг/кг в комбинации с ипилимумабом в дозе 1 мг/кг каждые 3 недели в количестве 4 доз, далее продолжалась терапия ниволумабом в дозе 3 мг/кг каждые 2 недели. Сунитиниб пациенты получали в стандартном режиме 4/2 в дозе 50 мг. Первичными конечными точками в исследовании были общая выживаемость, выживаемость без прогрессирования и частота объективных ответов в группе пациентов с промежуточным и плохим прогнозом.
Медиана общей выживаемости в группе сунитиниба была анонсирована в 2018 году и составила 26,6 месяца [14]. Исследователи выявили статистически значимые преимущества в пользу ниволумаба и ипилимумаба со снижением риска смерти при использовании комбинации на 34% (HR=0,66; P<0,0001). Удивительно и в то же время показательно, что на протяжении двух лет медиана продолжительности жизни в этой группе не была достигнута – более 50% больных оставались живы. На GU ASCO в 2020 году авторы представили результаты исследования при минимальном наблюдении в течение 42 месяцев [15]. Медиана общей выживаемости в группе ниволумаба-ипилимумаба составила 47 месяцев. Могли мы раньше ожидать того, что пациенты с плохим и промежуточным прогнозом будут жить 4 года? Таблица 1, в которой приведены результаты проспективных исследований и метаанализов, отвечает на этот вопрос.
Таблица 1. Общая выживаемость больных метастатическим ПКР, имеющих промежуточный и плохой прогноз.
| Общая выживаемость | Цитокины | Темсиролимус | Ингибиторы тирозинкиназы |
Ниволумаб + ипилимумаб |
|---|---|---|---|---|
| Промежуточный прогноз, мес. | 14,6 | – | 18,9 | 47 мес. |
| Плохой прогноз, мес. | 4,5 | 10,9 | 6,2 |
Источники: Motzer RJ et al., J Clin Oncol 2000; Hudes et al., NEJM 2007; Bamias et al., Br J Cancer 2013; Gore et al., British Journal of Cancer 2015; Tannir N et al., 2020 GU ASCO. Медиана общей выживаемости у пациентов, получавших комбинацию ниволумаба и ипилимумаба, может измениться при дальнейшем цензурировании данных.
42-месячная общая выживаемость составила 56% и 47% в группах комбинации и сунитиниба соответственно. Снова хотелось бы сравнить эти данные с российскими. В исследовании RENSUR3, объединившем результаты 8 российских регионов, 36-месячная общая выживаемость составила 21%, а медиана – 12 месяцев [16]. Из этого можно заключить, что, применяя комбинацию ниволумаба и ипилимумаба в первой линии терапии в России, можно улучшить показатели выживаемости больных в 3-4 раза. Такие прогнозы должны использоваться в фармакоэкономических расчетах при планировании лекарственного лечения в каждом регионе, учитывая, что когорта пациентов с промежуточным и неблагоприятным прогнозом является значительной (около 66% больных находятся в этой группе [17]).
В исследовании CheckMate 214 медиана выживаемости без прогрессирования была 12 месяцев в группе комбинации и 8,3 месяца в группе сунитиниба (HR=0,76; P<0,01). По оценке независимого комитета, частота объективных ответов составила 42% у больных, получавших ингибиторы контрольных точек, и 26% в группе сунитиниба. 10% и 1% больных имели полные ответы на терапию ниволумабом-ипилимумабом и сунитинибом. Медиана длительности ответа не была достигнута в группе комбинации. Частота полных ответов в общей популяции и в когорте пациентов с благоприятным прогнозом по оценке независимого экспертного комитета составила 11% и 13% соответственно. На момент проведения оценки (медиана 42 мес.) 68% пациентов, достигших ответа, продолжают его удерживать. 86% пациентов с полным ответом продолжают сохранять полный ответ.
Наиболее частыми нежелательными явлениями 3-4 степени, связанными с иммунотерапией, были повышения уровней липазы (10%), амилазы (6%) и аланинаминотрансферазы (5%), тогда как в группе сунитиниба чаще встречалась гипертензия (17%), усталость (10%) и ладонно-подошвенный синдром (9%). Частота всех нежелательных явлений 3-4 степени составила 47% и 64% в группах иммунотерапии и сунитиниба соответственно. Полное прекращение терапии отмечалось у 22% пациентов, что было связано с невозможностью корректировки дозы иммуноонкологических препаратов. Назначение глюкокортикоидов в высоких дозах понадобилось 35% пациентов. Интересным представляется анализ общей выживаемости в группе пациентов, которым терапия ниволумабом и ипилимумабом была отменена из-за токсичности. При медиане наблюдения 42 месяца 66% больных, прекративших лечение, были живы, и это оказалось минимум не хуже, чем у пациентов в общей группе (56%).
Таким образом, на основании результатов исследования CheckMate 214 комбинацию ниволумаба и ипилимумаба одобрили в России и других странах для использования у пациентов с метастатическим светлоклеточным ПКР, относящихся к группе промежуточного и плохого прогноза. Комбинация была включена в российские и международные рекомендации (таблица 2).
Таблица 2. Рекомендации NCCN (версия 2, 2020 год):
первая линия терапии метастатического светлоклеточного ПКР.
| Предпочтительный режим | Другие рекомендованные режимы | Режимы, используемые в некоторых случаях | |
|---|---|---|---|
| Благоприятный прогноз | Акситиниб + пембролизумаб Пазопаниб Сунитиниб |
Ипилимумаб + ниволумаб Кабозантиниб (категория 2B) Акситиниб + авелумаб |
Активное наблюдение Акситиниб (категория 2B) ИЛ-2 в высоких дозах |
| Плохой/промежуточный прогноз | Ипилимумаб + ниволумаб (категория 1) Акситиниб + пембролизумаб (категория 1) Кабозантиниб |
Пазопаниб Сунитиниб Акситиниб + авелумаб |
Акситиниб (категория 2B) ИЛ-2 в высоких дозах Темсиролимус |
Будущее иммунотерапии
Каким можно представить будущее иммунотерапии рака почки? Во-первых, появляются антитела, блокирующие новые контрольные точки. Например, комбинация полностью человеческого антитела к LAG3 релатлимаба (80 мг) и ниволумаба (240 мг) уже изучается в клинических исследованиях, в том числе с включением больных ПКР. LAG3 – это белок, который связывает молекулы главного комплекса гистосовместимости (MHC II класса), тем самым значительно подавляя активность иммунной системы. Тройная блокада PD-1, CTLA-4 и LAG3 также представляет научный интерес. Недавно стартовало клиническое исследование 1/2 фазы по оценке безопасности и предварительной эффективности комбинации релатлимаба, ниволумаба и ипилимумаба в двух когортах (NCT03459222).
Во-вторых, иммунотерапия делает попытку перемещения от первой линии лечения метастатического ПКР в адъювантные и неоадъювантные режимы. Многие специалисты принимают участие в рандомизированном исследовании 3 фазы PROSPER (NCT03055013), в котором пациенты со стадией ПКР Т2 и выше и метастазами в регионарные лимфатические узлы начинают получать ниволумаб до хирургического лечения, а затем продолжают после операции. Классическое «адъювантное» исследование 3 фазы CheckMate 914 оценивает эффективность комбинации ниволумаба и ипилимумаба у пациентов, имеющих высокий риск прогрессирования болезни после хирургического лечения (NCT03138512).
И, наконец, может будущее комбинированной иммунотерапии заключается в вытеснении хирургического лечения у пациентов с маленькими опухолями почки? Ведь у 10% больных исчезли все метастазы при использовании ниволумаба и ипилимумаба в исследовании CheckMate 214, а значит, есть вероятность исчезновения маленьких опухолей при локализованном ПКР. В пилотном исследовании 2 фазы оценивается частота полных ответов у больных раком почки T1aN0M0, получающих комбинацию, и в ближайшем будущем мы получим эти результаты (NCT04134182).
Источники:
Статья предоставлена компанией BMS. Публикуется в редакции авторов.